题目内容
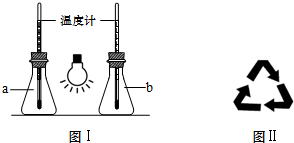
14.低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究的主要课题.最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如下:(如图1)
(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=.
④实验3中,若平衡时的转化率α(CO)>α(H2O),则$\frac{a}{b}$的取值范围是0<$\frac{a}{b}$<1.
分析 (1)KHCO3受热易分解;
(2)依据热化学方程式和盖斯定律计算得到;
(3)甲醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,正极是氧气得到电子生成氢氧根离子,依据原电池原理分析书写电极反应;
(4)Na2CO3溶液的浓度为0.02mol/L,等体积混合后溶液中c(CO32-)=0.01mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(5)①根据v=$\frac{△c}{△t}$计算反应速率;
②根据平衡常数表达式计算出实验2的平衡常数;
③根据温度变化,平衡时的生成物的物质的量的多少判断平衡移动的方向,判断反应热的符号;
④由于CO与H2O的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等,要使CO转化率大于H2O的转化率,则增大H2O的物质的量.
解答 解:(1)KHCO3受热易分解,向分解池中通入高温水蒸气,提供高温环境使KHCO3分解,故答案为:提供高温环境使KHCO3分解;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol,
得到热化学方程式为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol,
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(3)甲醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)Na2CO3溶液的浓度为0.02mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×0.02mol/L=0.01mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{0.01}$mol/L=2.8×10-7mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-7mol/L=5.6×10-7mol/L,
故答案为:5.6×10-7mol/L;
(5)①v(CO2)=v(CO)=$\frac{\frac{4mol-2.4mol}{2L}}{6min}$=0.13 mol/(L.min),故答案为:0.13 mol/(L.min);
②实验2中达到平衡时,c(CO2)=c(H2)=$\frac{0.4mol}{2L}$=0.2mol/L,c(CO)=$\frac{1.6mol}{2L}$=0.8mol/L,c(H2O)=$\frac{1mol-0.4mol}{2L}$=0.3mol/L,
K=$\frac{0.2×0.2}{0.8×0.3}$≈0.17,
故答案为:0.17;
③根据CO(g)+H2O(g)?CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为1.2mol,而900℃时CO的物质的量应为1.6mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0,
故答案为:<;
④由于CO与H2O的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2O的转化率,则增大H2O的物质的量,即$\frac{a}{b}$的值小于1,所以$\frac{a}{b}$的取值范围是0<$\frac{a}{b}$<1,
故答案为:0<$\frac{a}{b}$<1.
点评 本题考查了盖斯定律的应用、原电池原理、反应速率的计算、平衡常数的计算与运用、溶度积的有关计算等,题目综合性较强,是对学生能力的考查,难度中等,注意把握反应原理的有关内容.

 通城学典默写能手系列答案
通城学典默写能手系列答案| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | Fe2(SO4)3•9H2O |
| A. | 食醋 | B. | 食盐 | C. | 淀粉 | D. | 白糖 |
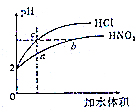 室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )
室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )| A. | 原HNO2溶液的浓度为0.01mol•L-1 | |
| B. | 溶液中水的电离程度:b>c | |
| C. | $\frac{c(N{{O}_{2}}^{-})}{c(HN{O}_{2})•c(O{H}^{-})}$比值:b>a | |
| D. | 等浓度的HNO2与NaOH溶液按体积比为2:1充分反应的混合液中,c(NO2-)+2c(OH-)=c(HNO2)+2c(H+) |
 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.