题目内容
2.《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”据此推测,“青矾”的主要成分为( )| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | Fe2(SO4)3•9H2O |
分析 “青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe203超细粉末为红色;
解答 解:“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe203超细粉末为红色,
A为蓝色晶体,
B为FeSO4•7H2O是绿色晶体,
C为KAl(SO4)2•12H2O是无色晶体,
D为Fe2(SO4)3•9H2O为黄色晶体,
所以判断“青矾”的主要成分为FeSO4•7H2O,故选B.
点评 本题考查了物质性质、物质颜色的掌握,掌握基础是解题关键,主要是亚铁盐和铁盐转化的颜色变化,信息理解是关键,题目较简单.

练习册系列答案
相关题目
12.下列对生活中有关化学问题的分析不正确的是( )
| A. | 钙和磷都是人体内含量丰富的矿物元素,属于常量元素 | |
| B. | 白色污染是指聚乙烯、聚氯乙烯等各种废塑料制品造成的污染 | |
| C. | 具有强吸附性的活性炭能吸附某些溶于水中的杂质,并能对水进行消毒 | |
| D. | 青霉素等抗生素对某些微生物有抑制或杀灭作用,但对人体细胞的毒性很低 |
13.下列物质暴露在空气中,会发生风化的是( )
| A. | 食盐 | B. | 石碱 | C. | 烧碱 | D. | 氧化钙 |
10.下列过程中,属于化学变化的是( )
| A. | 石油分馏 | B. | 用蒸馏法制取蒸馏水 | ||
| C. | 干冰气化 | D. | 电解水制氧气 |
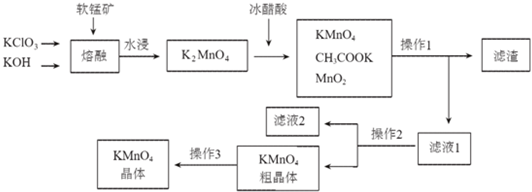
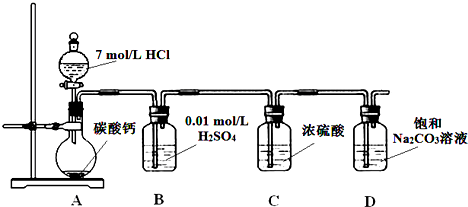
7.高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):
相关物质不同温度下的溶解度(单位:g)数据如表:
(1)“熔融”步骤反应的化学方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O.
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK,若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低.

相关物质不同温度下的溶解度(单位:g)数据如表:
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK,若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低.
14.低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究的主要课题.最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如下:(如图1)
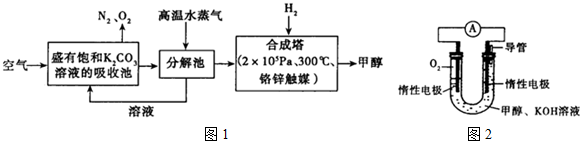
(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
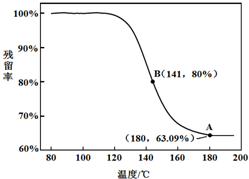
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
①实验1前6min的反应速率v(CO2)=0.13 mol/(L.min)(保留小数点后两位,下同).
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=.
④实验3中,若平衡时的转化率α(CO)>α(H2O),则$\frac{a}{b}$的取值范围是0<$\frac{a}{b}$<1.

(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=.
④实验3中,若平衡时的转化率α(CO)>α(H2O),则$\frac{a}{b}$的取值范围是0<$\frac{a}{b}$<1.
11.下列化学用语表示正确的是( )
| A. | Mg2+的结构示意图: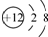 | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | H2O2的电子式: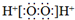 | |
| D. | 硫酸的电离方程式:H2SO4═H22++SO42- |
 和
和 ⑧乙烷和戊烷
⑧乙烷和戊烷