题目内容
9.张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: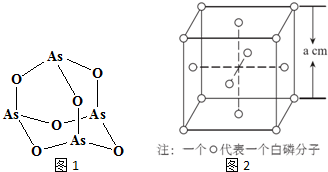
(1)As原子的核外电子排布式为1s22s22p63s23p63d104s24p3.
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大.
(3)NH4+中H-N-H的键角比NH3中H-N-H的键角大(填“大”或“小”),原因是NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力.
(4)Na3AsO4中含有的化学键类型包括离子键、共价键;AsO43-的空间构型为正四面体,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是sp3.
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是离子晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol-l,则该晶胞中含有的P原子的个数为16,该晶体的密度为$\frac{496}{{a}^{3}{N}_{A}}$g•cm-3(用含NA、a的式子表示).
分析 (1)As原子核外电子数为33,根据能量最低原理书写核外电子排布式;
(2)P的3p亚层是半充满状态,比较稳定,第一电离能高于同周期相邻元素的;
(3)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力;
(4)Na3AsO4属于离子化合物,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,据此判断空间构型;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;
(5)化合物NH5中的所有原子最外层都满足稳定结构,则由铵根离子与氢负离子构成;
(6)根据均摊法可知,晶胞中P4分子数目为4,则晶胞中含有16个P原子,计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)As原子核外电子数为33,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)P的3p亚层是半充满状态,比较稳定,第一电离能高于同周期相邻元素的,第一电离能大于硫的,
故答案为:P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大;
(3)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H-N-H的键角比NH3中H-N-H的键角大,
故答案为:大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力;
(4)Na3AsO4属于离子化合物,含有离子键,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化,
故答案为:离子键、共价键;正四面体;sp3;
(5)化合物NH5中的所有原子最外层都满足稳定结构,则由铵根离子与氢负离子构成,属于离子晶体,故答案为:离子;
(6)根据均摊法可知,晶胞中P4分子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞中P原子数目为4×4=16,晶胞质量为16×$\frac{31}{{N}_{A}}$g,晶胞体积为(a cm)3,则晶胞密度为$\frac{4×\frac{31}{{N}_{A}}g}{(acm)^{3}}$=$\frac{496}{{a}^{3}{N}_{A}}$g.cm-3,
故答案为:$\frac{496}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、价层电子对互斥联立、杂化方式与空间构型判断、化学键、晶胞计算等,是对物质结构主干知识的考查,需要学生具备扎实的基础与灵活运用能力,难度中等,掌握均摊法进行有关晶胞计算.

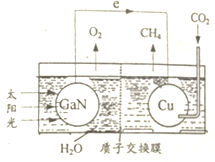 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是( )
| A. | 该装置中存在两种能量的转换形式 | |
| B. | 电池工作时,H+向负极移动 | |
| C. | 为提高该人工光合系统的工作效率,最好向装置中加入少量盐酸 | |
| D. | 铜电极表面的电极反应式为:C02+8e-+8H+═CH4+2H20 |
 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
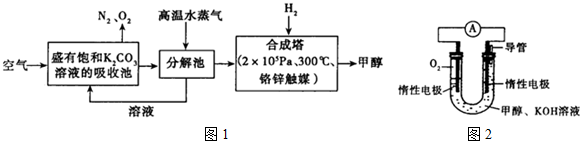
(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=.
④实验3中,若平衡时的转化率α(CO)>α(H2O),则$\frac{a}{b}$的取值范围是0<$\frac{a}{b}$<1.
| A. | 是一种无色粘稠状的液体 | B. | 常温下使Cu发生钝化 | ||
| C. | 使蔗糖变黑体现其吸水性 | D. | 可用于干燥氨气 |
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: ;反应类型:取代反应
;反应类型:取代反应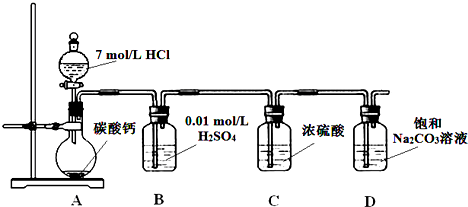
 太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( )
太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( ) 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.