题目内容
10.某化学反应的反应物和产物如下:10Al+6NaNO3+6H2O═4Al(OH)3+3N2↑+6NaAlO2
①该反应的氧化剂是NaNO3.
②该反应的氧化产物是A1(OH)3、NaA1O2.
③反应过程中转移5mol电子,生成标准状况下N2的体积为11.2L.
④用单线桥表示该反应的电子转移的方向和数目

分析 反应Al+NaNO3+H2O→Al(OH)3+N2↑+NaAlO2中,Al元素化合价升高,被氧化,为还原剂,N元素化合价由+5价降低到0价,被还原,NaNO3为氧化剂,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相同,以此解答该题.
解答 解:(1)N元素化合价由+5价降低到0价,被还原,NaNO3为氧化剂,故答案为:NaNO3;
(2)Al元素化合价升高,被氧化,氧化产物为A1(OH)3、NaA1O2,故答案为:A1(OH)3、NaA1O2;
(3)N元素化合价由+5价降低到0价,转移5mol电子,则生成0.5molN2,体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2;
(4)反应10Al+6NaNO3+6H2O═4Al(OH)3+3N2↑+6NaAlO2中,Al元素化合价升高,被氧化,为还原剂,N元素化合价由+5价降低到0价,被还原,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,电子转移如下: ,故答案为:
,故答案为: .
.
点评 本题考查氧化还原反应知识,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度认识相关概念和相关计算,难度中等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
1.2.0mol H2和1.0mol I2(g)充入体积不变的密闭容器中,在一定条件下发生下述反应:H2(g)+I2(g)?2HI(g),达平衡时,HI为0.40mol,如果此时移走1.0mol H2和0.50mol I2(g),在相同温度下再达到平衡时,HI的物质的量是( )
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20mol | D. | 大于0.20 mol,小于0.40 mol |
5.下列物质与水作用形成的物质能与氯化铵作用形成氨气的是( )
| A. | 二氧化氮 | B. | 钠 | C. | 硫酸镁 | D. | 二氧化硅 |
2.下列反应的离子方程式书写正确的是( )
| A. | 向四氧化三铁中加入稀硫酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2至沉淀质量最大Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4+2H2O | |
| C. | 向CuSO4溶液中加入金属钠:2Na+Cu2+═2Na ++Cu | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.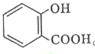 的名称为:2-羟基苯甲酸;在核磁共振氢谱中会出现6组峰;写出其与KHCO3溶液反应的化学方程式:
的名称为:2-羟基苯甲酸;在核磁共振氢谱中会出现6组峰;写出其与KHCO3溶液反应的化学方程式: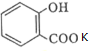 +CO2↑+H2O.
+CO2↑+H2O.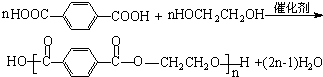 .
.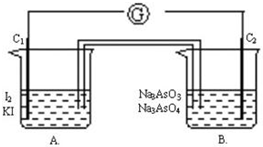 根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
 .
.