题目内容
13.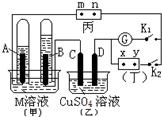 如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:
如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:(1)M溶液可能是BC(填序号).
A.KCl溶液 B.Ba(OH)2溶液 C.KNO3溶液 D.CuCl2溶液
(2)乙池中盛有足量的硫酸铜溶液,D电极上的电极反应式为2H2O-4e-=4H++O2↑,此时向溶液中加入0.16克CuO可以使溶液完全复原.
(3)滤纸丙上m点附近变为蓝色,n点附近变为红色,
(4)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现电流计G指针发生偏转,若M为硫酸溶液,写出B电极上发生的反应式O2+4e-+4H+=2H2O.
分析 A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml,A、B两极产生的气体体积之比为2:1,则A电极上生成氢气,B电极上生成氧气,所以A为阴极,B为阳极,x为正极,y为负极,
(1)电解M的溶液实质上是电解水,可为强碱溶液或活泼金属的含氧酸盐等;
(2)根据电解硫酸铜溶液的反应特征分析判断恢复溶液浓度需要加入的物质,依据电荷守恒计算需要加入物质的质量;
(3)m为阳极,发生氧化反应生成碘,n为阴极,发生还原反应生成氢气和KOH;
(4)形成燃料电池,B为正极.
解答 解:A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml,A、B两极产生的气体体积之比为2:1,则A电极上生成氢气,B电极上生成氧气,所以A为阴极,B为阳极,x为正极,y为负极,
(1)电解KNO3溶液、Ba(OH)2溶液溶液实际上是电解水,电解氯化钾溶液是电解氯化钾和水,电解氯化铜溶液生成氯气和铜,所以只有BC符合;
故答案为:BC;
(2)D为阳极,发生氧化反应,电极方程式为2H2O-4e-=4H++O2↑,乙反应的化学方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+2H2SO4+O2↑,
B极产生的气体体积为22.4mL,则n(O2)=0.001mol,转移0.004mol电子,由方程式可知生成0.001mol氧气,0.002mol铜,即生成0.002molCuO,应加入m(CuO)=0.001mol×80g/mol=0.16g,
故答案为:2H2O-4e-=4H++O2↑;0.16克CuO;
(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,所以m端滤纸变蓝,n为阴极,发生还原反应生成氢气和KOH,滴加酚酞溶液变红色,
故答案为:蓝;红;
(4)形成燃料电池,B为正极,氧气得到电子生成水,电极方程式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O.
点评 本题综合考查原电池和电解池知识,是高考中的常见题型和重要的考点之一,属于中等难度的试题,题目有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,注意根据电解现象判断阴阳极和正负极.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案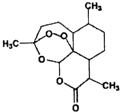 屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )
屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )| A. | 青蒿素的结构中含有过氧键受热容易分解 | |
| B. | 乙醚的结构简式为:CH3OCH3 | |
| C. | 青蒿素溶于热水,所以应加热加快溶解 | |
| D. | 乙醚易溶于水,不能用分液的方法分离 |
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20mol | D. | 大于0.20 mol,小于0.40 mol |
| A. | 实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 | |
| B. | 向2%的硝酸银溶液中滴入2%的稀氨水,直至产生的沉淀恰好溶解,配得银氨溶液 | |
| C. | 采用水浴加热,不能直接加热 | |
| D. | 可用浓盐酸洗去银镜 |
| A. | 二氧化氮 | B. | 钠 | C. | 硫酸镁 | D. | 二氧化硅 |
| A. | 向四氧化三铁中加入稀硫酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2至沉淀质量最大Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4+2H2O | |
| C. | 向CuSO4溶液中加入金属钠:2Na+Cu2+═2Na ++Cu | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.