题目内容
2.在氯化镁和氯化铝的混合液中,Mg2+的物质的量为0.04mol,Al3+的物质的量为0.06mol.要使Mg2+全部转化为沉淀而分离出来,至少需要加入4mol/L NaOH溶液的体积为( )| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
分析 根据电荷守恒可知:2n(Mg2+)+3n(Al3+)=n(Cl-),欲使Mg2+全部沉淀分离出来,可发生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH)=n(NaCl)+(NaAlO2)=n(Cl-)+n(Al3+),进而计算需要氢氧化钠溶液体积.
解答 解:Mg2+的物质的量为0.04mol,Al3+的物质的量为0.06mol,
溶液中存在2n(Mg2+)+3n(Al3+)=n(Cl-)=2×0.04+3×0.06=0.26mol,
欲使Mg2+全部沉淀分离出来,可发生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH)=n(NaCl)+(NaAlO2)=n(Cl-)+n(Al3+)=0.26mol+0.06mol=0.32mol,
可知至少需要加入4mol/L NaOH溶液的体积为$\frac{0.32mol}{4mol/L}$=0.08L=80mL,
故选C.
点评 本题考查离子反应的计算,为高频考点,把握发生的反应及原子、电荷守恒为解答的关键,注意利用守恒思想简化解题,解答关键在于清楚反应后溶液为NaCl、NaAlO2的混合液,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
10.以下说法错误的是( )
| A. | 从分子中碳骨架形状分:异丁烷为链状有机化合物,甲苯为环状有机化合物 | |
| B. | 蒸馏常用于分离提纯液态有机混合物 | |
| C. | 核磁共振氢谱通常用于分析有机物的相对分子质量 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
17.下列物质长期露置在空气中,不会因为发生氧化还原反应而变质的是( )
| A. | Fe(OH)2 | B. | Na | C. | Na2O2 | D. | NaOH |
7.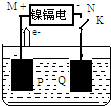 镍镉电池是一种十分常见的二次电池,它具有成本低、性能好的优点.该电池充、放电时的反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.如图用该电池电解AgNO3溶液,M、N是代表电池的两极,P、Q表示两惰性电极,Cd的相对原子质量为112,则下列有关说法不正确的是( )
镍镉电池是一种十分常见的二次电池,它具有成本低、性能好的优点.该电池充、放电时的反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.如图用该电池电解AgNO3溶液,M、N是代表电池的两极,P、Q表示两惰性电极,Cd的相对原子质量为112,则下列有关说法不正确的是( )
 镍镉电池是一种十分常见的二次电池,它具有成本低、性能好的优点.该电池充、放电时的反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.如图用该电池电解AgNO3溶液,M、N是代表电池的两极,P、Q表示两惰性电极,Cd的相对原子质量为112,则下列有关说法不正确的是( )
镍镉电池是一种十分常见的二次电池,它具有成本低、性能好的优点.该电池充、放电时的反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.如图用该电池电解AgNO3溶液,M、N是代表电池的两极,P、Q表示两惰性电极,Cd的相对原子质量为112,则下列有关说法不正确的是( )| A. | N是镍镉电池的负极,其电极反应为Cd+2OH--2e-=Cd(OH)2 | |
| B. | 当N极有11.2gCd溶解时,P极放出气体2.24L | |
| C. | K闭合后的短时间内,N极区溶液的pH变小 | |
| D. | Q是电解池的阴极,其电极反应为Ag++e-=Ag |
14.证明某溶液只含有Fe2+而不含有Fe3+的最佳实验操作是( )
| A. | 只需加KSCN溶液 | B. | 只需加NaOH溶液 | ||
| C. | 先加KSCN溶液,再加氯水 | D. | 先加氯水,再加KSCN溶液 |
11.25℃时,下列有关溶液中各微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) | |
| D. | pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) |
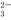 、S
、S O
O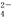 三种离子,如果只取一次该溶
三种离子,如果只取一次该溶 液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。