题目内容
12.白磷剧毒,白磷中毒可用硫酸铜溶液解毒,白磷和硫酸铜发生如下反应;(1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列说法中正确的是( )
| A. | 在上述两个反应中,当有1molP参加反应时,反应转移电子数均为5NA | |
| B. | 在反应(2)中,当生成3mol硫酸时,被还原的P为1mol | |
| C. | 在上述两个反应中,P均作还原剂 | |
| D. | 在上述两个反应中,还原产物都是H3PO4 |
分析 2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4该反应中P元素化合价由0价变为5价,Cu元素化合价由+2价变为0价;
11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4该反应中P元素化合价由0价变为-3价、+5价,Cu元素化合价由+2价变为+1价,如果有11molP参加氧化还原反应,则有$\frac{6}{11}$的P被氧化,其余的P被还原,据此分析解答.
解答 解:2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4该反应中P元素化合价由0价变为5价,Cu元素化合价由+2价变为0价;
11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4该反应中P元素化合价由0价变为-3价、+5价,Cu元素化合价由+2价变为+1价,如果有11molP参加氧化还原反应,则有$\frac{6}{11}$的P被氧化,其余的P被还原,
A.在反应(2)中,11molP参加氧化还原反应,则有$\frac{6}{11}$的P被氧化,则当有1molP参加反应时,被氧化的P为$\frac{6}{11}$mol,转移电子为$\frac{6}{11}$mol×5,反应转移电子数为$\frac{30}{11}$NA,故A错误;
B.在反应(2)中,生成15molH2SO4,被还原的P为$\frac{5}{11}$×11mol=5mol,则当生成3mol硫酸时,被还原的P为1mol,故B正确;
C.在反应(2)中,P元素化合价由0价变为-3价、+5价,所以P既是氧化剂又是还原剂,故C错误;
D.在反应(1)中,P元素被氧化,H3PO4是氧化产物,故D错误;
故选B.
点评 本题考查氧化还原反应,明确元素化合价变化是解本题关键,注意该反应中P元素化合价变化,为易错点,侧重于考查学生对基础知识的应用能力.

| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 高温、高压、催化剂 |
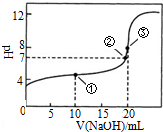 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点③所示溶液中:c(CH3COO-)>c(Na+) |
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下加入浓硫酸 | |
| D. | 上述说法均不正确 |
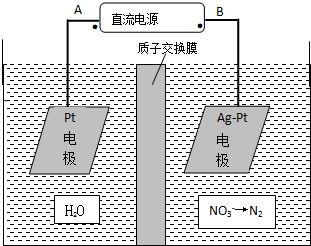 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题: ,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2.
,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2.