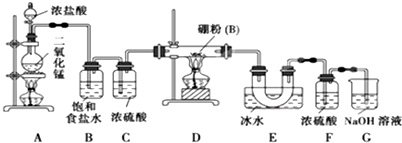
题目内容
16.解痉药奥昔布宁的前体(化合物丙)的合成路线如图,下列叙述正确的是( )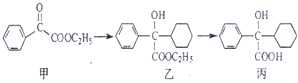
| A. | 化合物甲中的含氧官能团有 羰基和酯基 | |
| B. | 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 | |
| C. | 化合物乙中含有1个手性碳原子 | |
| D. | 在NaOH醇溶液中加热,化合物丙可发生消去反应 |
分析 A.甲中官能团是羰基、酯基;
B.乙中含有酯基,能和NaOH水溶液在加热条件下发生水解反应;
C.连接四个不同原子或原子团的碳原子为手性碳原子;
D.醇在浓硫酸催化剂、加热条件下能发生消去反应,且醇羟基连接的碳原子相邻碳原子上必须含有氢原子.
解答 解:A.根据结构简式知,甲中含氧官能团名称是酯基和羰基,故A正确;
B.乙中含有酯基,在NaOH碱性条件下发生水解反应生成-COONa而不是-COOH,故B错误;
C.乙中连接醇羟基的碳原子为手性碳原子,故C正确;
D.丙在氢氧化钠的醇溶液中不能发生消去反应,应该在浓硫酸作催化剂、加热条件下发生消去反应,故D错误;
故选AC.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,知道手性碳原子判断方法、醇发生消去反应所需条件,题目难度不大,易错选项是D.

练习册系列答案
相关题目
6.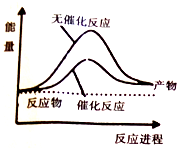 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
一定条件下,在体积1L的密闭容器中加入1mol CO(g)和2mol H2(g)充分反应,生成CH3OH(g)放出热量Q kJ,下列说法正确的是( )
 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下| H2(g) | CO(g) | CH3OH(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 1084 | a |
| A. | 上图可表示合成甲醇过程中的能量变化 | |
| B. | a的数值为2047 | |
| C. | Q的数值为91 | |
| D. | 其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量 |
4.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下加入浓硫酸 | |
| D. | 上述说法均不正确 |
11.H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示,下列说法正确的是( )
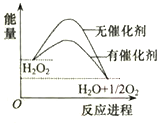

| A. | 元素O的单质存在O2和O3两种同位素 | |
| B. | 加入催化剂,减小了H2O2分解反应的热效应 | |
| C. | 若H2O2分解产生1molO2,理论上转移4mol电子 | |
| D. | H2O2和Na2O2所含化学键类型不同 |
6.一江清水送北京是十堰人民对首都人民的承诺,水质问题很重要,十堰某地有两个工厂的污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-.两厂单独处理成本很高,如果将两厂的污水按一定比例混合,过滤沉淀后污水就变为无色澄清且只含NaNO3,污染程度大大降低.关于污染源的分析,你认为正确的是( )
| A. | Cl- 和NO3-一定来自不同的工厂 | B. | SO42- 和NO3-可能来自同一工厂 | ||
| C. | Ag+ 和Na+ 可能来自同一工厂 | D. | Na+ 和NO3-一定来自同一工厂 |
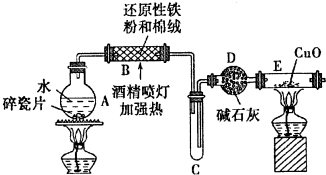
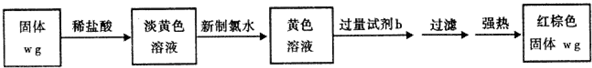
 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题: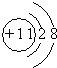 ;
;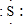 ,E离子的符号为Cl-;
,E离子的符号为Cl-;