题目内容
19.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾(FeSO4•7H2O)的流程如图: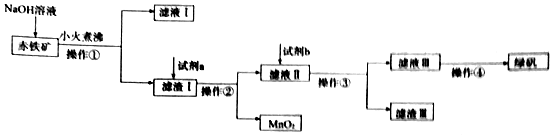
(1)滤液Ⅰ中所含的阴离子有OH-、AlO2-、SiO32-.
(2)试剂a为硫酸,试剂b投入到滤液Ⅱ发生的所有反应的方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=Cu+FeSO4、Fe+H2SO4=H2↑+FeSO4.
(3)实验室中操作①所需的玻璃仪器有玻璃棒、漏斗、烧杯.
(4)操作④的名称为蒸发浓缩、冷却结晶、过滤(洗涤、干燥).
分析 赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等),由制备流程可知,加NaOH后,Al2O3、SiO2与NaOH反应,则滤液I中含OH-、AlO2-、SiO32-,滤渣I中含Fe2O3、FeO、MnO2、CuO,加试剂a为硫酸,操作①②均为过滤,滤液Ⅱ中含硫酸、Fe2(SO4)3、FeSO4、CuSO4,试剂b为Fe,操作③为过滤,滤渣Ⅲ为Cu、Fe,滤液Ⅲ含FeSO4,蒸发浓缩、冷却结晶得到绿矾,以此来解答.
解答 解:(1)由上述分析可知,滤液Ⅰ中所含的阴离子有OH-、AlO2-、SiO32-,
故答案为:OH-、AlO2-、SiO32-;
(2)试剂a为硫酸,试剂b投入到滤液Ⅱ发生的所有反应的方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=Cu+FeSO4、Fe+H2SO4=H2↑+FeSO4,
故答案为:硫酸;Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=Cu+FeSO4、Fe+H2SO4=H2↑+FeSO4;
(3)实验室中操作①为过滤,所需的玻璃仪器有玻璃棒、漏斗、烧杯,
故答案为:玻璃棒、漏斗、烧杯;
(4)操作④的名称为蒸发浓缩、冷却结晶、过滤(洗涤、干燥),可得到绿矾晶体,
故答案为:蒸发浓缩、冷却结晶、过滤(洗涤、干燥).
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
2.在恒温恒的密闭容器中,发生反应:A(g)+3B(g)?nC(g).Ⅰ.将1molA和3molB在一定条件下反应,达平衡时C的体积分数为x;Ⅱ.若起始时A、B、C投入的物质的量分别为a、b、c(均不为零),平衡时C的体积分数液为x,下列说法正确的是( )
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则C转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中在加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足2a+1<b<3 |
11.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H=-283.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
8.已知25℃时,AgCl的Ksp=1.8×10-10,下列说法正确的是( )
| A. | 在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 | |
| B. | 在任何含AgCl固体的溶液中都存在c(Ag+)=c(Cl-) | |
| C. | 向饱和AgCl水溶液中加入盐酸,其Ksp值变大 | |
| D. | 将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)=9×10-10mol/L |
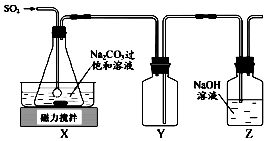 焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.