题目内容
2.某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成: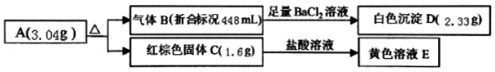
请回答:
(1)写出红棕色固体C的化学式Fe2O3.
(2)写出A受热分解反应的化学方程式2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2↑.
(3)写出检验A中阳离子的实验方案取少量试样配成溶液'再滴入KSCN溶液不变色,再滴加少量氯水,出现血红色,证明有亚铁离子.
分析 n(B)=$\frac{0.448L}{22.4L/mol}$=0.02mol,生成白色沉淀D为BaSO4,且n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,说明n(SO3)=0.01mol,红综合固体为Fe2O3,n(Fe2O3)=$\frac{1.6g}{160g/mol}$=0.01mol,说明A含有Fe、S、O等元素,B中还含有SO2,且n(SO2)=0.01mol,以此解答该题.
解答 解:(1)由以上分析可知C为Fe2O3,故答案为:Fe2O3;
(2)由以上分析可知n(SO3)=0.01mol,n(SO2)=0.01mol,n(Fe2O3)=0.01mol,且m(SO3)+m(SO2)+m(Fe2O3)=0.01mol×80g/mol+0.01mol×64g/mol+1.6g=3.04g,说明A中n*Fe):n(S):n(O)=1:1:4,A为FeSO4,分解的方程式为2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2↑,
故答案为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2↑;
(3)检验亚铁离子,可取少量试样配成溶液'再滴入KSCN溶液不变色,再滴加少量氯水,出现血红色,证明有亚铁离子,
故答案为:取少量试样配成溶液'再滴入KSCN溶液不变色,再滴加少量氯水,出现血红色,证明有亚铁离子.
点评 本题考查无机物的推断以及物质的组成的判断,为高频考点,把握二氧化硫的性质、铁离子检验为解答的关键,侧重分析与推断能力的考查,注意从质量守恒的角度判断A的化学式,题目难度不大.

练习册系列答案
相关题目
11.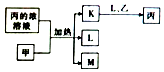 短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y | B. | 元素的非全属性:Z>Y>X | ||
| C. | 化合物XYZ中只含共价键 | D. | K、L、M中沸点最高的是M |
10.常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)常温下,等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,试分析原因:NO2-水解显碱性,对铵根离子水解起到促进作用.0.1mol•L-1NH4NO2溶液中离子浓度由大到小的顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-),NO2-水解反应的平衡常数Kh=1.4×10-11 mol•L-1(保留两位有效数字).
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH>7 (填“>”、“<”或“=”);反应NH3•H2O+H2CO3?NH4++HCO3-+H2O的平衡常数K=800.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O═HCO3-+HClO:
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH>7 (填“>”、“<”或“=”);反应NH3•H2O+H2CO3?NH4++HCO3-+H2O的平衡常数K=800.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O═HCO3-+HClO:
17.常温常压下,将H2S和O2的混合气体100mL引入反应器中在一定条件下充分反应,恢复到原状况,发现尚留气体25mL.则原混合气体中H2S和O2的体积比为( )
| A. | 1:1 | B. | 4:3 | C. | 3:1 | D. | 3:2 |
7.地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题.用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图1所示.
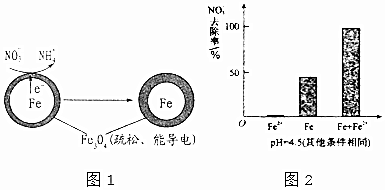
作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
在pH=4.5的水体中,NO3-的去除率低的原因是FeO(OH)不导电,阻碍电子转移.
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)
(1)Fe还原水体中NO3-的反应原理如图1所示.

作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 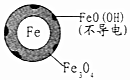 | 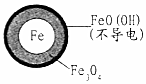 |
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)
14.下列图示的实验操作,能实现相应实验目的是( )
| A. |  蒸干CuCl2饱和溶液制备无水CuCl2 | |
| B. | 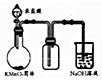 实验室制取并收集少量纯净氯气 | |
| C. | 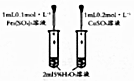 研究催化剂对H2O2分解速率的影响 | |
| D. | 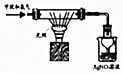 验证甲烷和氧气光照条件下发生取代反应 |
11.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊 | 酸性:碳酸>苯酚 |
| B | 向1mL 0.1mol•L-1 MgSO4溶液中,滴入2滴0.1mol•L-1 NaOH溶液,产生白色沉淀,再滴入2滴0.1mol•L-1CuSO4溶液,白色沉淀逐渐变为蓝色 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| C | 向蛋白质溶液中加入甲醛溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
| D | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.化学与生产、生活密切相关,下列有关说法正确的是( )
| A. | 沼气是可再生资源,电能是二次能源 | |
| B. | 对“地沟油”进行蒸馏即可得到汽油 | |
| C. | 用焦炭还原铝土矿即可获得金属铝 | |
| D. | 从海水提取物质都必须通过化学反应方可实现 |