题目内容
16.常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则C1/C2=10-4.分析 酸抑制水电离,含有弱根离子的盐促进水电离,以此解答该题.
解答 解:常温下,设pH=5的H2SO4的溶液中由水电离出的H+浓度C1=10-9 mol/L,pH=5的Al2(SO4)3溶液中由水电离出的H+浓度C2=10-5mol/L,则$\frac{{C}_{1}}{{C}_{2}}$=$\frac{1{0}^{-9}}{1{0}^{-5}}$=10-4,
故答案为:10-4.
点评 本题考查了弱电解质的电离、pH的简单计算,明确弱电解质的电离特点是解本题关键,知道影响水电离的因素,灵活运用基本公式并结合电解质特点来分析解答,难度中等.

练习册系列答案
相关题目
6.CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色.向反应后溶液中通入过量SO2,溶液变成无色.下列说法正确的是( )
| A. | 滴加KI溶液时,CuI是还原产物,KI被还原 | |
| B. | 通入SO2后,溶液变无色,体现SO2的漂白性 | |
| C. | 整个过程发生了复分解反应和氧化还原反应 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
7.下列离子方程式书写正确的是( )
| A. | Ba(OH)2溶液中加入少量NaHSO4:OH-+H+═H2O | |
| B. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | NaOH溶液中通入足量的CO2:OH-+CO2═HCO3- | |
| D. | Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
4.在自然界中只能以化合态存在的元素是( )
| A. | 氮 | B. | 氯 | C. | 硫 | D. | 碳 |
11.下列说法正确的是( )
| A. | 试纸在使用时必须先要湿润 | |
| B. | 任何金属或者它们的化合物在火焰上灼烧都有特殊的焰色反应 | |
| C. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| D. | 提纯混有少量硝酸钾的氯化钠,需经过溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤 |
1. 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如表:
(1)当反应进行到20min时,该段时间内H2的平均反应速率是0.0035mol/(L•min).
(2)该温度下,该反应的化学平衡常数是0.053(保留两位有效数字).
(3)若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.
 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是0.053(保留两位有效数字).
(3)若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.
5.乙酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 乙酸与水能以任意比例互溶 | |
| B. | 乙酸溶液的导电性弱 | |
| C. | 10 mL1 mol•L-1乙酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 | |
| D. | 1 mol•L-1的乙酸溶液的C(H+)约为0.01 mol•L-1 |
5.反应N2(g)+O2(g)═2NO(g)的过程中的能量变化如图所示,下列有关说法中正确的是( )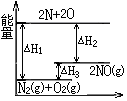

| A. | △H3>0 | B. | △H2为该反应的反应热 | ||
| C. | 反应N2(g)+O2(g)═2NO(g)为放热反应 | D. | △H3=△H1-△H2 |