题目内容
12.A~G是几种烃分子的球棍模型(如图),据此回答下列问题: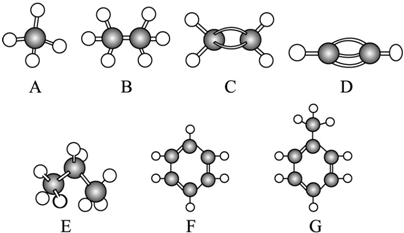
(1)常温下含碳量最高的气态烃是(填对应字母)D
(2)能够发生加成反应的烃有(填对应字母)GCDFG
(3)一卤代物种类最多的是(填对应字母)G
(4)写出C发生加聚反应的化学方程式:

(5)写出D制备C的化学方程式:HC≡CH+H2$\stackrel{一定条件}{→}$CH2=CH2.
分析 有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,根据物质的组成、结构和性质解答该题.
解答 解:有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,
(1)常温下含碳量最高的气态烃是乙炔,故答案为:D;
(2)能够发生加成的烃有有乙烯、乙炔、苯和甲苯4种,故答案为:CDFG;
(3)一卤代物种类最多的是甲苯,共有4种,故答案为:G;
(4)C为乙烯,可发生加成反应生成聚乙烯,方程式为 ,故答案为:
,故答案为: ;
;
(5)乙炔和氢气在一定条件下发生加成反应可生成乙烯,方程式为HC≡CH+H2$\stackrel{一定条件}{→}$CH2=CH2,
故答案为:HC≡CH+H2$\stackrel{一定条件}{→}$CH2=CH2.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握有机物的结构特点,根据结构模型判断有机物的种类,为解答该题的关键.

练习册系列答案
相关题目
13.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为结论正确的是( )
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
10.NA代表阿伏伽德罗常数,下列关于电子转移的说法正确的是( )
| A. | 5.6g Fe参与反应转移的电子数一定为0.2NA | |
| B. | 2.3g Na参与反应转移的电子数一定为0.1NA | |
| C. | 标况下,2.24L Cl2参与反应转移的电子数一定为0.2NA | |
| D. | 标况下,2.24L O2参与反应转移的电子数一定为0.4NA |
4.下列叙述正确的是( )
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
2.2011年,瑞士洛桑联邦工学院无理学家发现后用一种辉钼(MoS2)单分子层材料制造半导体,比传统硅材料和富勒烯更有优势.工业上用辉钼矿冶炼钼的化学原理:
①2MoS2+7O2$\stackrel{高温}{→}$2MoO3+4SO2 ②MoO3+2NH3•H2O═(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl═H2MoO4↓+2NH4Cl ④H2MoO4═MoO3+H2O
⑤用还原剂将MoO3还原成金属钼,下列说法正确的是( )
①2MoS2+7O2$\stackrel{高温}{→}$2MoO3+4SO2 ②MoO3+2NH3•H2O═(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl═H2MoO4↓+2NH4Cl ④H2MoO4═MoO3+H2O
⑤用还原剂将MoO3还原成金属钼,下列说法正确的是( )
| A. | MoS2煅烧产生的尾气可直接排到空气中 | |
| B. | MoO3不溶于氢氧化钠溶液 | |
| C. | H2MoO4是一种强酸 | |
| D. | 利用H2、CO和Al分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2 |

 .
.