��Ŀ����
6��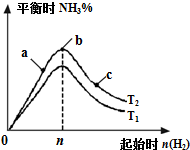 ij����С���о��������������������£��ı���ʼ�������ʵ���[��n��H2����ʾ]��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol ��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ����ͼ��ʾ�Ĺ��ɣ�T��ʾ�¶ȣ�n��ʾ���ʵ�������
ij����С���о��������������������£��ı���ʼ�������ʵ���[��n��H2����ʾ]��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol ��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ����ͼ��ʾ�Ĺ��ɣ�T��ʾ�¶ȣ�n��ʾ���ʵ���������1�����������Ӧ�����������ܱ������з���������Ӧ�ﵽƽ��ʱ����ȷ��������b��ѡ���ţ���
a��2v����NH3��=3v����H2�� b��NH3���������ֲ���
c��v��H2��=3v��N2�� d����Ӧ�ﲻ��ת��Ϊ������
��2���Ƚ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ���c����Ӧ����������c��
��3��ͼ����T1��T2�����������������=������ͬ����Ϊʲô�÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ��������¶�ΪT1��T2ʱ����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2��
���������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧc��ѡ���ţ���
a��һ��������Ӧ�����ƶ� b������������ѹǿ
c��һ�����淴Ӧ�����ƶ� d���ﵽ��ƽ��ʱ��Ӧ��������
e���ﵽ��ƽ��ʱ��Ӧ���ʼ�С
��4��T2�����£��������ݻ�Ϊ2L���������ʵ���Ϊn mol����Ӧ�ﵽƽ��ʱN2��H2��ת���ʾ�Ϊ60%��������ʼʱ��ϵ�м���N2�����ʵ���Ϊ1mol���ú�n�Ĵ���ʽ��ʾ������n��H2��=3mol����Ӧ��ƽ�ⳣ��K=$\frac{25}{3}$��������ֵ���÷�����ʾ����
���� ��1�����淴Ӧ�ﵽƽ��״̬ʱ���淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ������ɴ������һϵ�����������䣻
��2��a��b��c���㣬n��H2��Խ��ƽ�������ƶ��ij̶�Խ��N2��ת����Խ��ѹǿԽ��Ӧ����Խ�죻
��3�����������ʵ�����ͬʱ���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��Խ����ƽ�������ƶ����¶�Խ��ƽ�������ƶ�������ƽ�ⳣ����С��
��ѧƽ�ⳣ��ֻ���¶��йأ���ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��4��T2�����£��������ݻ�Ϊ2L���������ʵ���Ϊn mol����Ӧ�ﵽƽ��ʱN2��H2��ת���ʾ�Ϊ60%����μӷ�Ӧ��n��H2��=60%nmol�����ݷ���ʽ֪��������ʼʱ��ϵ�м���N2��n��N2��=$\frac{\frac{1}{3}��60%nmol}{60%}$=$\frac{1}{3}$nmol��
��n��H2��=3mol��n��N2��=1mol����Ӧ�ﵽƽ��ʱN2��H2��ת���ʾ�Ϊ60%����ƽ��ʱc��H2��=$\frac{3mol����1-60%��}{2L}$=0.6mol/L��c��N2��=$\frac{1mol����1-60%��}{2L}$=0.2mol/L��c��NH3��=$\frac{3mol��60%��\frac{2}{3}}{2L}$=0.6mol/L����Ӧ��ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$��
��� �⣺��1��a��v����NH3����v����H2��=2��3ʱ�÷�Ӧ�ﵽƽ��״̬�����Ե�2v����NH3��=3v����H2�� ʱ�÷�Ӧû�дﵽƽ��״̬���ʴ���
b��NH3���������ֲ���ʱ�����淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ȷ��
c��v��H2��=3v��N2��ʱ��û����ȷ���淴Ӧ���ʣ��������ж��Ƿ�ﵽƽ��״̬���ʴ���
d�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ֹͣ���ʴ���
��ѡb��
��2��a��b��c�����У�n��H2��Խ��ƽ�������ƶ��ij̶�Խ��N2��ת����Խ��c��ʱ���������ʵ������c��N2��ת������ߣ�ѹǿԽ��Ӧ����Խ�죬���������ʵ���Խ��ѹǿԽ��Ӧ����Խ�죬��Ӧ����������c�㣬�ʴ�Ϊ��c��c��
��3�����������ʵ�����ͬʱ���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��Խ����ƽ�������ƶ�������T1��T2���¶�Խ��ƽ�������ƶ�������ƽ�ⳣ����С��T1��T2����ƽ�ⳣ��K1��K2��
��ѧƽ�ⳣ��ֻ���¶��йأ���ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ����������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧһ�����淴Ӧ�����ƶ���
�ʴ�Ϊ�������÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ƽ��ƽ�������ƶ�������c��
��4��T2�����£��������ݻ�Ϊ2L���������ʵ���Ϊn mol����Ӧ�ﵽƽ��ʱN2��H2��ת���ʾ�Ϊ60%����μӷ�Ӧ��n��H2��=60%nmol�����ݷ���ʽ֪��������ʼʱ��ϵ�м���N2��n��N2��=$\frac{\frac{1}{3}��60%nmol}{60%}$=$\frac{1}{3}$nmol��
��n��H2��=3mol��n��N2��=1mol����Ӧ�ﵽƽ��ʱN2��H2��ת���ʾ�Ϊ60%����ƽ��ʱc��H2��=$\frac{3mol����1-60%��}{2L}$=0.6mol/L��c��N2��=$\frac{1mol����1-60%��}{2L}$=0.2mol/L��c��NH3��=$\frac{3mol��60%��\frac{2}{3}}{2L}$=0.6mol/L��
��Ӧ��ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{0��{6}^{2}}{0��{6}^{3}��0.2}$=$\frac{25}{3}$��
�ʴ�Ϊ��1��$\frac{25}{3}$��
���� ���⿼����ۺϣ��漰��ѧƽ����㡢��ѧƽ��״̬�жϡ���ѧƽ��Ӱ�����ص�֪ʶ�㣬Ϊ��Ƶ���㣬��ȷ��ѧƽ��ԭ������ѧƽ�ⳣ�������ǽⱾ��ؼ���ע�⣺��ѧƽ�ⳣ��ֻ���¶��йأ�������ʵ�Ũ�ȼ������ʵ�ת�����أ�

��2 mol NaOH��1 mol Ba(OH)2��2 mol Na[Al(OH)4]�Ļ����Һ������ͨ��CO2����ͨ��CO2���������ɳ��������Ĺ�ϵ����ȷ����( )
ѡ�� | A | B | C | D |
n(CO2)(mol) | 2 | 3 | 4 | 6 |
n(����)(mol) | 1 | 2 | 3 | 2 |
| Ԫ�� | X | Y | Z |
| ��� ��Ϣ | ʳ���д��ڵ� ����Ԫ�� | ��һ�ֵ�������Ȼ ���ڵ���Ӳ������ | �ؿ��к��� ����Ԫ�� |
��1��Z��Ԫ�ط�����O��
��2��X��Ԫ��ԭ�����ױ��X+����ԭ���ǽ�����ǿ��
��3��Y�ĵ����벻�����Z�ĵ��ʷ�Ӧ�������Ļ�ѧʽΪCO��
��4��YZ2����X�������������Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪCO2+2NaOH=Na2CO3+H2O��
��5����X��Y��Z����Ԫ����ɵĻ�������һ������ϡ�����Ϻ������Ϊ���������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪNa2CO3+2HCl=2NaCl+H2O+CO2����
| A�� | ����������Һ�Լ��ԣ�SO32-+2 H2O?H2SO3+2 OH- | |
| B�� | �Ȼ���Ͷ��ˮ�к���ƽ�⣺AgCl ��s��?Ag+��aq��+Cl-��aq�� | |
| C�� | �����ȼ����Ϊ890.3kJ•mol-1����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ�� CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ•mol-1 | |
| D�� | 500�桢30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��$?_{500�桢30MPa}^{����}$ 2NH3��g����H=-38.6 kJ•mol-1 |
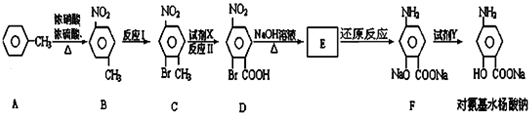
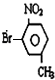 ��
��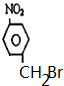 ��
��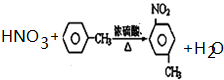 ��ע����Ӧ��������
��ע����Ӧ��������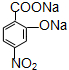 ��
�� �����е��Ļ��ϼ�Ϊ-2�ۣ�
�����е��Ļ��ϼ�Ϊ-2�ۣ�