题目内容
16.已知咖啡酸的结构如图所示,关于咖啡酸的描述正确的是( )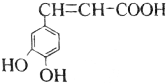
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3molCO32- |
分析 A.该芳香族化合物有三个取代基,分别为两个酚羟基、一个-CH=CH-COOH,与该分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物,为变换三个官能团在苯环上的位置;
B.羧基和酚羟基可发生缩聚反应;
C.苯环能与氢气加成,但羧基中的羰基不能与氢气加成;
D.1mol酚羟基与足量的Na2CO3溶液反应,能消耗1molCO32-,1mol羧基与足量的Na2CO3溶液反应,能消耗0.5molCO32-.
解答 解:A.该芳香族化合物有三个取代基,分别为两个酚羟基、一个-CH=CH-COOH,与该有机物符合条件的异构体为官能团在苯环上的位置不同,分别为: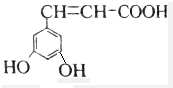 、
、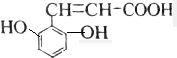 、
、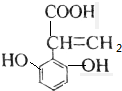 、
、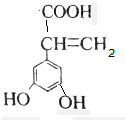 ,共有4种,故A正确;
,共有4种,故A正确;
B.咖啡酸碳碳双键能发生加成反应生成高分子化合物,羧基和酚羟基可发生缩聚反应生成高分子化合物,故B错误;
C.苯环与双键与氢气发生加成反应,则1mol咖啡酸最多可与4mol氢气发生加成反应,故C错误;
D.1mol酚羟基与足量的Na2CO3溶液反应,能消耗1molCO32-,生成酚钠,1mol羧基与足量的Na2CO3溶液反应,能消耗0.5molCO32-,生成二氧化碳,1mol该物质与足量的Na2CO3溶液反应,能消耗2.5molCO32-,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、烯烃性质的考查,注意D中酚与羧酸性质的差别,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
6.尿黑酸是苯丙氨酸和酪氨酸的中间产物,其结构简式为 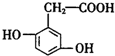 ,则下列说法错误的是( )
,则下列说法错误的是( )
 ,则下列说法错误的是( )
,则下列说法错误的是( )| A. | 1mol尿黑酸与足量的浓溴水反应,最多消耗3mol Br2 | |
| B. | 1mol尿黑酸最多能与4mol H2反应 | |
| C. | 尿黑酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 尿黑酸可与碳酸氢钠溶液反应放出CO2,生成2.24LCO2(标况下)需要尿黑酸16.8g |
11.在室温下,0.1mol•L-1100ml 的醋酸溶液中,欲使其溶液的c(H+)增大,但又要使醋酸电离程度减少,应采取( )
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入少量纯醋酸 |
4.自来水中游离氯的测定.设计如下实验:取一定量自来水置于锥形瓶中,加入足量的KI溶液及2~3滴指示剂,用0.0010mol•L-1的Na2S2O3溶液滴定反应中生成的I2(I2被还原为I-,S2O32-被氧化为S4O62-),根据消耗的Na2S2O3溶液的体积计算出自来水中游离氯的浓度.请回答下列问题:
(1)写出Na2S2O3与I2反应的离子方程式I2+2S2O32-=2I-+S4O62-.
(2)滴定中使用的指示剂是淀粉溶液,滴定终点的现象是蓝色溶液恰好变为无色且半分钟内不恢复.
(3)该小组同学的实验数据如下表:
请根据上表数据计算该自来水中游离氯(Cl2)的物质的量浓度.0.0010mol•L-1(写出计算过程,否则不得分)
(4)若实验中的锥形瓶用自来水洗净后未用蒸馏水洗涤,则实验值大于(填“大于、小于或等于”)实际值.
(1)写出Na2S2O3与I2反应的离子方程式I2+2S2O32-=2I-+S4O62-.
(2)滴定中使用的指示剂是淀粉溶液,滴定终点的现象是蓝色溶液恰好变为无色且半分钟内不恢复.
(3)该小组同学的实验数据如下表:
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
(4)若实验中的锥形瓶用自来水洗净后未用蒸馏水洗涤,则实验值大于(填“大于、小于或等于”)实际值.
11.某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
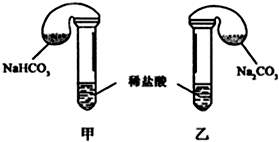
(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+=CO2↑+H2O.
(2)当试管中不再有气体生成时,两组实验出现不同现象,填写下表的空格.

(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+=CO2↑+H2O.
(2)当试管中不再有气体生成时,两组实验出现不同现象,填写下表的空格.
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
8.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径A>B>D>C | B. | 原子序数a>b>c>d | ||
| C. | 离子半径D>C>B>A | D. | 金属性B>A,非金属性D>C |