题目内容
11.某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答: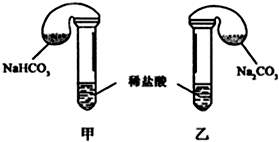
(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+=CO2↑+H2O.
(2)当试管中不再有气体生成时,两组实验出现不同现象,填写下表的空格.
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
分析 (1)甲装置发生反应HCO3-+H+═H2O+CO2↑,乙装置发生反应CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,据此判断反应速率大小;
(2)根据n=$\frac{m}{M}$分别计算出碳酸氢钠、碳酸钠的物质的量,再根据n=cV计算出盐酸中含有HCl的物质的量,然后根据反应方程式判断过量情况,从而可知甲和乙的反应现象及原因.
解答 解:(1)甲装置发生反应为:HCO3-+H+═H2O+CO2↑,乙装置发生反应为:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,甲装置内反应速率较快,单位时间产生的CO2多,故甲装置中的气球体积先变大,
故答案为:甲;HCO3-+H+═H2O+CO2↑;
(2)第②组中碳酸氢钠的物质的量为:n=$\frac{m}{M}$=$\frac{42g}{84g/mol}$=0.5mol,碳酸钠的物质的量为:n=$\frac{m}{M}$=$\frac{53g}{106g/mol}$=0.5mol,则n(NaHCO3)=n(Na2CO3),300mL3 mol/L盐酸中含有HCl的物质的量为:3mol/L×0.3L=0.9mol
HCO3-+H+═H2O+CO2↑,0.5mol碳酸氢钠完全反应消耗0.5molHCl,而0.5mol碳酸钠CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,完全反应消耗1molHCl,显然甲中盐酸过量,乙中盐酸不足量,则甲乙装置中放出二氧化碳的体积大小为:V(CO2)甲>V(CO2)乙,所以甲中气球比乙中气球的体积大,
故答案为:大于;甲中盐酸过量,乙中盐酸不足量、n(NaHCO3)=n(Na2CO3)、V(CO2)甲>V(CO2)乙.
点评 本题考查了碳酸钠、碳酸氢钠的性质,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握碳酸钠、碳酸氢钠的化学性质,试题培养了学生的分析能力及化学实验能力.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 硫酸铵 | B. | 绿矾 | C. | 摩尔盐 | D. | 硫酸 |
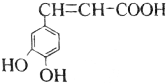
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3molCO32- |
 某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:
某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:①称取W g样品,准确配成500mL溶液.
②准确配制0.1000mol/L的标准盐酸.
③用滴定管取所配制碱液25.00mL于锥形瓶,并向瓶中滴几滴甲基橙试液.
④向锥形瓶中逐滴滴入标准盐酸,直到终点.
⑤记录数据,计算.请回答:
(1)在①操作中要使用的定量的玻璃仪器是500ml容量瓶.
(2)操作④装标准盐酸的滴定管是酸式滴定管.
(3)滴定过程中左手控制酸式滴定管的活塞,右手向一个方向摇动锥形瓶.眼睛应始终注视锥形瓶内溶液的颜色变化,判断滴定到达终点的现象是滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色.
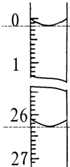
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为26.10ml.
(5)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=26.20 |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
③根据上面结果计算NaOH的纯度$\frac{2.096}{W}$×100%.
(6)下列操作中,可能使测定结果偏低的是ACF.
A.称取样品时,样品和砝码位置放反了
B.配制标准盐酸过程中,读取量筒读数时,俯视刻度线
C.碱式滴定管清洗后,未用待测液润洗
D.酸式滴定管清洗后,未用待测液润洗
E.锥形瓶装液前未干燥,有水珠附着在瓶壁
F.读取酸式滴定管读数时,第一次读数仰视,第二次读数俯视.
| A. | 向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- | |
| B. | 将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含钾 | |
| C. | 待检液逐滴加入NaOH溶液,有白色胶状沉淀产生,后来沉淀逐渐消失,则原溶液中可能含有Al3+ | |
| D. | 待检液中先加入KSCN溶液,无明显现象,再加入氯水,溶液显血红色,则待检液中一定含有Fe2+ |
| A. | CO2通入到 CaCl2溶液中 | |
| B. | NH3通入 AlCl3溶液中 | |
| C. | 用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体中 |
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.I.制备
称取14.0g CuSOd•5H20、16.0g Na2CO3.10H20,用研钵分别研细后再混合研磨,立即发生反应,有“滋滋”声,而且混合物很快成为“黏胶状”.将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
(1)①混合物发生反应时有“滋滋”声的原因是有气体生成.
②检验生成物已洗涤干净的方法是取最后一次洗涤液少许于试管中,加入适量盐酸酸化后滴加氯化钡溶液,若无沉淀生成,则没有SO42-,否则含有SO42-
Ⅱ.组成测定
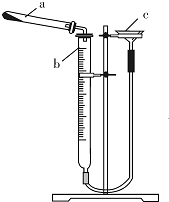
有同学查阅资料发现用Cu(OH)2.CuC03表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2.nCuC03,不同来源的碱式碳酸铜的m、n值需要具体测定.热分解法测定碱式碳酸铜组成的实验装置如图所示.通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值.
(2)①仪器b的名称是碱式滴定管.
②检查装置气密性的方法是连接好装置,通过漏斗向装置中加水,至右侧水面比左侧水面高,静置,水面高度差不发生变化,则装置不 漏气,否则装置漏气.
③三次平行实验测定结果如下表,则该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”、“偏小”或“不变”).
| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
(1)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物H2SO4 HCl(填写化学式).
(2)现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜.火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 $\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO,每转移0.6mol电子,有0.1mol硫被氧化.
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O.
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
 .
.