题目内容
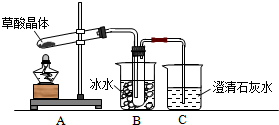
7.如图所示为某化学兴趣小组设计的乙醇氧化并验证其氧化产物的实验装置(图中加热装置、夹持装置等均未画出).据题意回答下列问题.(1)装置A宜采取的加热方式是水浴加热加热.装置E也需要加热,E的作用是制备氧气.
(2)加热F试管,出现砖红色沉淀,说明乙醇已被氧化.
(3)C处的现象是出现蓝色,B处发生反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)实验完成后发现A中还有液体剩余,冷却后投入一小块金属钠,有气泡生成,写出发生反应的化学方程式:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,酞试液滴人反应后的溶液中,溶液显示红色,说明乙醇钠显碱性.
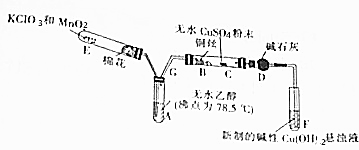
分析 乙醇在铜催化作用下加热与氧气发生氧化还原反应生成乙醛和水,实验中E用于制备氧气,生成的氧气通入A中,形成氧气和乙醇的混合气体,在B中加热条件下反应生成乙醛和水,可用C检验水的生成,用银氨溶液检验是否生成乙醛,以此解答该题.
(1)根据水浴加热和直接加热的区别及实验目的分析;根据实验目的分析E装置的作用,氯酸钾受热分解为氯化钾和氧气;
(2)醛类能和氢氧化铜悬浊液反应生成砖红色沉淀;
(3)B处发生乙醇发生催化氧化生成乙醛和水,白色的无水硫酸铜与水作用生成蓝色的五水合硫酸铜;
(4)乙醇和钠反应生成乙醇钠和氢气,酚酞与显碱性溶液作用显示红色.
解答 解:乙醇在铜催化作用下加热与氧气发生氧化还原反应生成乙醛和水,实验中E用于制备氧气,生成的氧气通入A中,形成氧气和乙醇的混合气体,在B中加热条件下反应生成乙醛和水,可用C检验水的生成,用银氨溶液检验是否生成乙醛.
(1)装置A直接加热时,生成乙醇蒸汽的速率较大,乙醇和氧化铜反应不完全,造成资源浪费,为了使A中的乙醇平稳气化成蒸气,可采用水浴加热的方法;实验中E用于制备氧气,氯酸钾受热分解2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
故答案为:水浴加热;制备氧气;
(2)乙醛能和氢氧化铜悬浊液反应,生成砖红色沉淀,所以F中会产生砖红色沉淀,
故答案为:砖红色;
(3)B处发生乙醇发生催化氧化,反应的化学方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,C处为白色的无水硫酸铜,与水作用生成五水合硫酸铜显示蓝色,
故答案为:出现蓝色;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)乙醇和钠反应生成乙醇钠和氢气,2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,乙醇钠溶液与酚酞作用显示红色,显碱性,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;显示红色.
点评 本题考查了乙醇的化学性质,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的原理和操作方法,题目难度不大.

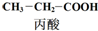 $→_{①}^{Cl_{2},红磷}$
$→_{①}^{Cl_{2},红磷}$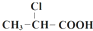 $→_{②}^{一定条件}$
$→_{②}^{一定条件}$ 下列说法正确的是( )
下列说法正确的是( )| A. | 步骤①、②分别是加成反应、取代反应 | B. | 蛋白质水解也可生成乳酸 | ||
| C. | 丙酸烃基上的二氯代物有2种 | D. | 乳酸与丙烯完全燃烧的产物相同 |
| A. | BaSO4的水溶液不导电,故BaSO4是弱电解质 | |
| B. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | AgCl在同温、同浓度的CaCl2和NaCl溶液中的溶解度不同 |
①淀粉 ②纤维素 ③油脂 ④蔗糖 ③聚乙烯.
| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | 全部 |
| A. | 硫酸铵 | B. | 绿矾 | C. | 摩尔盐 | D. | 硫酸 |
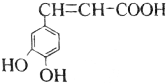
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3molCO32- |
| A. | CO2通入到 CaCl2溶液中 | |
| B. | NH3通入 AlCl3溶液中 | |
| C. | 用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体中 |
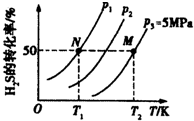 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.