题目内容
2.工业上利用无机矿物资源生产部分材料的流程示意图如图.下列说法不正确的是( )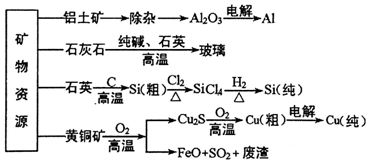
| A. | 在铝土矿制备较高纯度A1的过程中常用到NaOH溶液、CO2气体、冰晶石 | |
| B. | 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 | |
| C. | 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2:1 | |
| D. | 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物 |
分析 A.由铝土矿制备较高纯度A1,可用氧化铝与氢氧化钠反应生成偏铝酸钠溶液,过滤后通入二氧化碳生成氢氧化铝,氢氧化铝分解生成氧化铝,电解氧化铝可生成铝;
B.石英主要成分为二氧化硅;
C.粗硅的反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,结合方程式判断;
D.黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO,Cu、O元素化合价降低.
解答 解:A.由铝土矿制备较高纯度A1,可用氧化铝与氢氧化钠反应生成偏铝酸钠溶液,过滤后通入二氧化碳生成氢氧化铝,氢氧化铝分解生成氧化铝,电解氧化铝可生成铝,电解时为降低熔点,可加入冰晶石,故A正确;
B.石英主要成分为二氧化硅,不是盐,与盐酸不反应,故B错误;
C.粗硅的反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,反应中二氧化硅为氧化剂,C为还原剂,则被氧化的物质与被还原的物质的物质的量之比为2:1,故C正确;
D.黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO,Cu、O元素化合价降低,则Cu2S、FeO均是还原产物,故D正确.
故选B.
点评 本题综合考查元素化合物知识,为高频考点,题目涉及金属的冶炼的考查,注意把握物质的性质以及反应原理,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
12.下列关于各图象的解释或得出结论正确的是( )
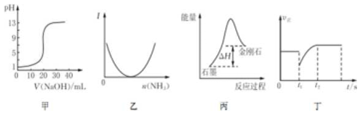

| A. | 图甲表示0.10mol•L-1NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 | |
| D. | 图丁表示反应2SO2+O2?2SO3,t1时刻只减小了 SO3的浓度 |
13.化学与生产、生活、社会发展等息息相关.下列说法正确的是( )
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| C. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 | |
| D. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 |
17.CH2=CH-COOCH3是重要的有机合成中间体,可以通过下列反应合成CH2=CH-COOH+CH3OH$\stackrel{一定条件}{→}$CH2=CH-COOCH3+H2O
下列说法错误的是( )
下列说法错误的是( )
| A. | 该有机合成反应属于取代反应 | |
| B. | CH2=CH-COOCH3分子中处于同一平面的原子最少有3个 | |
| C. | CH2=CH-COOH没有官能团相同的同分异构体 | |
| D. | CH2=CH-COOCH3可以发生加成、氧化、取代反应 |
14.在常温常压下,将100mLH2S与O2混合气体在一定条件下充分反应后,恢复到原来的状况,剩余气体25mL.下列判断错误的是( )
| A. | 原混合气体中H2S的体积可能是75mL | |
| B. | 原混合气体中O2的体积可能是50mL | |
| C. | 剩余25 mL气体可能全部是SO2 | |
| D. | 剩余25 mL气体可能是SO2与O2 |
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol Mg 在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA |
11.反应2SO2+O2?2SO3在密闭容器中达到化学平衡时,下列关于说法错误的是( )
| A. | SO3的生成速率等于它的消耗速率 | B. | v(SO2)正=2v(O2)逆 | ||
| C. | 各组分的反应速率均相等 | D. | 反应体系中混合物的组成保持不变 |

 .
.