题目内容
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1mol Mg 在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA |
分析 A、根据镁反应后变为+2价来分析;
B、CnH2n的最简式为CH2;
C、pH=13的氢氧化钡溶液中氢氧根浓度为0.1mol/L;
D、氢气所处的状态不明确.
解答 解:A、由于镁反应后变为+2价,故1mol镁反应转移2NA个电子,故A错误;
B、CnH2n的最简式为CH2,故14g此链烃中含有的CH2的物质的量为1mol,则含2NA个C-H键,故B正确;
C、pH=13的氢氧化钡溶液中氢氧根浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故C错误;
D、氢气所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
1.25℃时,向盛有50mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )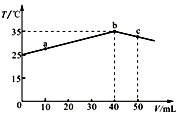

| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 |
2.工业上利用无机矿物资源生产部分材料的流程示意图如图.下列说法不正确的是( )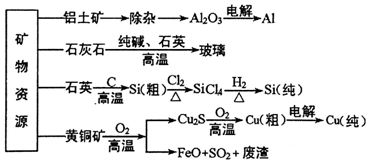

| A. | 在铝土矿制备较高纯度A1的过程中常用到NaOH溶液、CO2气体、冰晶石 | |
| B. | 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 | |
| C. | 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2:1 | |
| D. | 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物 |
19.下列晶体中熔点最高的是( )
| A. | 食盐 | B. | 硫磺 | C. | 金刚石 | D. | 钨 |
6.已知CH3COOH与CH3COONa两种溶质1:1的混合稀溶液呈酸性.该溶液中三种微粒浓度排序正确的是( )
| A. | c(CH3COO-)>c(Na+)>c(CH3COOH) | B. | c(CH3COOH)>c(Na+)>c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(CH3COOH) | D. | c(CH3COO-)>c(CH3COOH)>c(Na+) |
16.茉莉酮可用作食用香精,其结构如图所示,下列关于其叙述正确的是( )
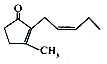

| A. | 茉莉酮易溶于水 | |
| B. | 茉莉酮中含有两种官能团 | |
| C. | 茉莉酮可与溴水、酸性KMnO4溶液发生加成反应,现象均为褪色 | |
| D. | 茉莉酮与二氢茉莉酮 互为同分异构体 互为同分异构体 |
3.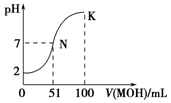 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| C. | K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol•L-1 | |
| D. | N点水的电离程度小于K点水的电离程度 |
20.根据实际及反应本质判断,下列化学反应中能设计成原电池的是( )
| A. | 2FeCl3+Cu═2FeCl2+CuCl2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | NaOH+HCl═NaCl+H2O | D. | C(s)+H2O(g)═CO(g)+H2(g) |
20.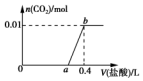 向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
 向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )| A. | 在0~a范围内,只发生NaOH和HCl的反应 | |
| B. | ab段发生反应的离子方程式为:CO32-+2H+═CO2↑+H2O | |
| C. | a=0.3 | |
| D. | 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |