题目内容
12.设阿伏加德罗常数为NA,下列说法正确的是( )| A. | 5.6 g Fe与足量盐酸反应,反应中转移的电子数为0.3NA | |
| B. | 0.1 mol FeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒 | |
| C. | 常温下,28 g的N2和CO混合气体含有的原子数为2NA | |
| D. | 1mol Na2O2和足量CO2充分反应,转移的电子数为2NA |
分析 A、求出铁的物质的量,然后根据铁和盐酸反应后变为+2价来分析;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、N2和CO的摩尔质量均为28g/mol,且均为双原子分子;
D、过氧化钠和二氧化碳的反应中,1mol过氧化钠转移1mol电子.
解答 解:A、5.6g铁的物质的量为0.1mol,而铁和盐酸反应后变为+2价,故0.1mol铁转移0.2NA个电子,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于0.1NA个,故B错误;
C、N2和CO的摩尔质量均为28g/mol,故28g混合物的物质的量为1mol,且两者均为双原子分子,故1mol混合物中含有2NA个原子,故C正确;
D、过氧化钠和二氧化碳的反应中,1mol过氧化钠转移1mol电子,故转移NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.下面列出了用惰性电极电解不同物质的电极反应式,其中错误的是( )
| A. | 电解饱和BaCl2溶液 阴极:Ba2++2e-=Ba | |
| B. | 电解Cu(NO3)2溶液 阴极:Cu2++2e-=Cu | |
| C. | 电解熔融NaCl阴极:Na++e-=Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-=2H2O+O2↑ |
7.为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO42-等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤 ②加适量盐酸 ③加过量的NaOH和Na2CO3混合溶液 ④加入过量BaCl2溶液.上述4项操作的正确顺序为( )
| A. | ②③④① | B. | ④②③① | C. | ④③①② | D. | ②①③④ |
17.在1.01×105Pa下,完全燃烧1体积乙醇和乙烯的混合气体,需同温同压下的氧气( )
| A. | 6体积 | B. | 4体积 | C. | 3体积 | D. | 无法确定 |
4.有6种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
| A. | ①②③⑤ | B. | ④⑥ | C. | ①④⑥ | D. | ②③⑤ |
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 3.7 g的2H35Cl含质子数为1.9NA | |
| B. | 16 g O3和O2混合物中氧原子数为NA | |
| C. | 100 mL 1 mol•L-1AlCl3溶液中含的阳离子数等于0.1NA | |
| D. | 标准状况下,33.6 L氯气与28 g铁充分反应,转移的电子数为3NA |
 中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:
中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题: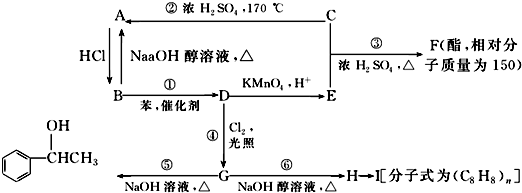
 .
. ;
; .
.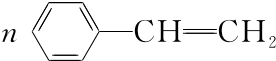 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$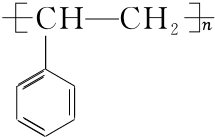 .
.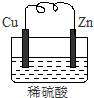 由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.
由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.