题目内容
20.请完成下列问题:(1)某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为1s22s22p63s13p5,.
(2)Fe的基态原子共有7种能量不同的电子.
(3)第二周期第一电离能介于B和N之间的元素有3种.
(4)甲醇(CH3OH)中的轻基被硫羟基取代生成甲硫醇(CH3SH).甲硫醇分子中S原子杂化轨道类型是sp3.
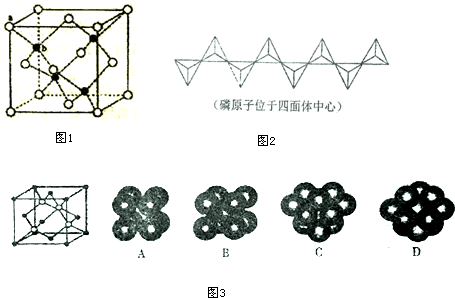
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图1所示,其晶胞边长为apm,a位置S2-与b位置Zn2+之间的距离为$\frac{\sqrt{3}}{4}$apm(列式表示).
(6)磷酸盐分为直链多磷酸盐、支链状超磷酸盐和环状聚偏磷酸盐三类.某直链多磷酸钠的阴离子呈如图2所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连.则该多磷酸钠的化学式为(NaPO3)n.
(7)碳化硅的晶胞结构(如图3)与金刚石类似(其中“●”为碳原子,“○”为硅原子),图中“●”点构成的堆积方式与图3中(A、B、C、D)D所表示的堆积方式相同.
(其中C为AB型D为ABC型)
分析 (1)基态S原子核外电子排布式1s22s22p63s23p5,其中某处于激发态的S原子,其中1个3s电子跃迁到3p轨道;
(2)Fe原子核外电子排布式为1s22s22p63s23p63d64s2;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的;
(4)甲硫醇分子中S原子形成2个σ键、含有2对孤对电子,杂化轨道数目为4;
(5)b位置黑色球与周围4个白色球构成正四面体结构,a位置白色球与黑色球b的连线处于晶胞体对角线上,其距离为晶胞体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍;
(6)P原子周围有4个O原子,其中2个氧原子分别为2个四面体结构共用,每个P与3个O形成阴离子,且P的化合价为+5价,再计算阴离子化合价判断化学式;
(7)由图3可知,碳原子为面心立方堆积,为ABC型堆积.
解答 解:(1)基态S原子核外电子排布式1s22s22p63s23p5,其中某处于激发态的S原子,其中1个3s电子跃迁到3p轨道,该激发态的S原子核外电子排布式为:1s22s22p63s13p5,
故答案为:1s22s22p63s13p5;
(2)Fe原子核外电子排布式为1s22s22p63s23p63d64s2,有7种能量不同的电子,故答案为:7;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的,第二周期第一电离能介于B和N之间的元素有Be、C、O 3种,
故答案为:3;
(4)甲硫醇分子中S原子形成2个σ键、含有2对孤对电子,杂化轨道数目为4,S原子杂化方式为sp3杂化,故答案为:sp3;
(5)b位置黑色球与周围4个白色球构成正四面体结构,a位置白色球与黑色球b的连线处于晶胞体对角线上,其距离为晶胞体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,故a位置S2-离子与b位置Zn2+离子之间的距离为$\frac{1}{4}$×$\sqrt{3}$a pm=$\frac{\sqrt{3}}{4}$a pm,
故答案为:$\frac{\sqrt{3}}{4}$a;
(6)P原子周围有4个O原子,其中2个氧原子分别为2个四面体结构共用,故每个P完全与3个O形成阴离子,且P的化合价为+5价,阴离子化合价为+5+3×(-2)=-1,故该该多磷酸钠的化学式为(NaPO3)n,
故答案为:(NaPO3)n;
(7)由图3可知,碳原子为面心立方堆积,为ABC型堆积,选项D符合,故答案为:D.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式判断、晶胞计算等,(5)中计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度较大.

 名校课堂系列答案
名校课堂系列答案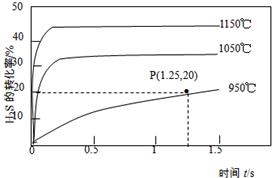 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |
| A. | 比例模型 可以表示二氧化碳分子 可以表示二氧化碳分子 | |
| B. | S2-的结构示意图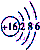 | |
| C. | 电子式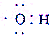 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 光气((COCl2)结构式: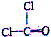 |
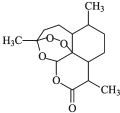 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
| A. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO | |
| D. | 单质钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ |
| A. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为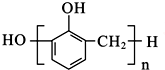 | |
| C. | 醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物 | |
| D. | 迷迭香酸的结构为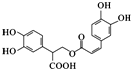 它可以发生酯化、水解但不能加成反应. 它可以发生酯化、水解但不能加成反应. |
| A. | 石墨 | B. | 液态HCl | C. | 葡萄糖 | D. | 熔融的Na2CO3 |
| A. | AlCl3为离子化合物 | B. | Mg与Cl形成共价键 | ||
| C. | SiCl4为共价化合物 | D. | K与Mg 形成共价键 |