题目内容
18.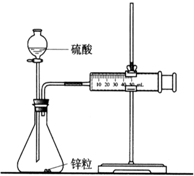 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.[实验目的]测量锌和稀硫酸反应的速率
[实验用品]锥形瓶、双孔塞、分液漏斗、直角导管、50mL注射器、铁架台、秒表、锌粒、1mol•L-1的H2SO4、4mol•L-1的H2SO4.
[实验步骤]
(1)甲同学取一套如图装置,加入40mL 1mol•L-1的H2SO4,测量收集10mL H2所需的时间.
(2)乙同学取另一套同样的装置,加入40mL 4mol•L-1的H2SO4,测量收集10mL H2所需的时间.
回答下列问题:
(1)Zn与稀H2SO4反应的离子方程式为Zn+2H+=Zn2++H2↑.
(2)收集10mL H2所需时间:甲大于乙(填“大于”、“小于”或“等于”,下同);反应速率:甲小于乙.
(3)下列说法不正确的是E(填字母).
A.本实验中甲、乙两同学所用锌粒的表面积要相同
B.装置气密性要好
C.40mL的H2SO4要迅速加入
D.收集气体还可以用排水法收集
E.若用98%的浓H2SO4,则反应最快
(4)测定Zn和稀H2SO4反应的速率还可用的方法有:
①测量等质量的Zn完全溶解所需要的时间;
②单位时间内H2SO4浓度的变化(或其他合理答案).
分析 (1)金属活动顺序表中排在氢前面的金属可从非强氧化性酸中置换出氢,金属锌可以和硫酸反应生成硫酸锌和氢气,据此书写离子方程式;
(2)浓度越大,反应速率越快,反应产生等量的气体需要的时间越短;
(3)A.研究浓度对反应速率的影响,本实验中所用锌粒的表面积要相同,根据控制变量法来回答;
B.根据测量收集10mL H2所需的时间,要求生成的氢气体积测定必须准确;
C.40mL的H2SO4要迅速加入,防止气体的体积测定误差的出现;
D.氢气的收集可以用排水法收集
E.若用98%的浓H2SO4,金属和浓硫酸的反应产物是二氧化硫,不是氢气;
(4)可通过测定测量等质量的Zn完全溶解所需要的时间、单位时间内H2SO4浓度的变化、收集等体积H2需要的时间长短等角度判断.
解答 解:(1)金属锌在金属活动顺序表中排在氢的前面,可以和硫酸反应生成硫酸锌和氢气,离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(2)1mol•L-1的H2SO4浓度小于4mol•L-1的H2SO4的,浓度越大,反应速率越快,反应产生等量的气体需要的时间越短,
故答案为:大于;小于;
(3)A.研究浓度对反应速率的影响,本实验中所用锌粒的表面积要相同,故A正确;
B.根据测量收集10mL H2所需的时间,要求生成的氢气体积测定必须准确,气密性必须好,故B正确;
C.40mL的H2SO4要迅速加入,防止气体的体积测定误差的出现,故C正确;
D.氢气不溶于水,收集可以用排水法收集,故D正确;
E.若用98%的浓H2SO4,金属和浓硫酸的反应产物是二氧化硫,不是氢气,故E错误.
故答案为:E;
(4)测定Zn和稀H2SO4反应的速率,测定反应物的变化,可通过测量等质量的Zn完全溶解所需要的时间; 单位时间内H2SO4浓度的变化,测定生成物,可通过收集等体积H2需要的时间长短,或其他合理答案,
故答案为:测量等质量的Zn完全溶解所需要的时间; 单位时间内H2SO4浓度的变化(或其他合理答案).
点评 本题考查了测定影响化学反应速率的因素方法,注意知识的迁移和应用是关键,题目难度不大.

| A. | 0.1 mol/L CH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | Na2S溶液中:c(OH-)═c(H+)+c(HS-)+2c(H2S) |
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol-1
H2O(g)═H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
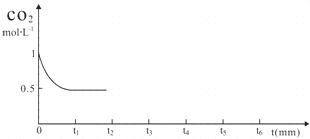
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
 ,反应的化学方程式为
,反应的化学方程式为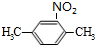 +H2O.
+H2O. 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: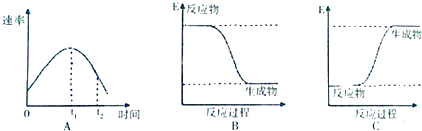
 (1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)
(1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)