题目内容
11. 由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,存在转化关系:甲$\stackrel{强酸溶液}{←}$丙$\stackrel{强碱溶液}{→}$乙
由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,存在转化关系:甲$\stackrel{强酸溶液}{←}$丙$\stackrel{强碱溶液}{→}$乙(1)若甲、乙、丙都是单质,甲、乙是同种气体,丙单质性质活泼,但由其制成的容器可用于储运浓硫酸,原因是常温下冷的浓硫酸能使铝钝化.
(2)若甲、乙是不同种气体,乙能使湿润的红色石蕊试纸变蓝.
①写出丙→甲反应的离子方程式:HCO3-+H+=CO2↑+H2O(任写一个)
②0.1mol乙与CuO(s)完全反应,得到一种气态单质、一种固态单质和一种液态化合物,放出14.7kJ的热量.该反应的热化学方程式为2NH3 (g)+3CuO(s)=3Cu(s)+N2(g)+3H2O(l)△H=-294 kJ•mol-1
③取20mL乙(其水合物的电离常数为K)的溶液,用0.10mol•L-1盐酸滴定.滴定过程中溶液pH变化如图所示.图中a、b、c、d四个点所代表的溶液中,c (OH-)≈K的是b(填字母).
分析 由短周期元素组成的甲、乙和丙均为中学常见物质,由转化关系可知,丙与酸、碱均反应,则丙可能为Al、酯、弱酸的铵盐等,
(1)若甲、乙、丙都是单质,甲、乙是同种气体,则丙为Al,气体为氢气,常温下Al遇浓硫酸发生钝化;
(2)若甲、乙是不同种气体,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,
①甲可以为二氧化碳,丙可能为NH4HCO3;
②由题目信息可知,发生反应2NH3+3CuO=3Cu+N2+3H2O,计算反应热,注明物质的聚集状态书写热化学方程式;
③一水合氨电离方程式为:NH3•H2O?NH4++OH-,其电离平衡常数K=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,若c(OH-)≈K,则溶液中c(NH4+)=c(NH3•H2O),滴定未达到终点,此时溶液呈碱性.
解答 解:由短周期元素组成的甲、乙和丙均为中学常见物质,由转化关系可知,丙与酸、碱均反应,则丙可能为Al、酯、弱酸的铵盐等,
(1)若甲、乙、丙都是单质,甲、乙是同种气体,则丙为Al,气体为氢气,常温下冷的浓硫酸能使铝钝化,则由其制成的容器可用于储运浓硫酸,
故答案为:常温下冷的浓硫酸能使铝钝化;
(2)若甲、乙是不同种气体,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,
①甲可以为二氧化碳,丙可能为NH4HCO3,丙→甲反应的离子方程式为:HCO3-+H+=CO2↑+H2O(或其它合理答案),
故答案为:HCO3-+H+=CO2↑+H2O;
②由题目信息可知,发生反应2NH3+3CuO=3Cu+N2+3H2O,2mol氨气反应放出的热量=14.7kJ×$\frac{2mol}{0.1mol}$=294kJ,故该反应热化学方程式为:2NH3 (g)+3CuO(s)=3Cu(s)+N2(g)+3H2O(l)△H=-294 kJ•mol-1,
故答案为:2NH3 (g)+3CuO(s)=3Cu(s)+N2(g)+3H2O(l)△H=-294 kJ•mol-1;
③一水合氨电离方程式为:NH3•H2O?NH4++OH-,其电离平衡常数K=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,若c(OH-)≈K,则溶液中c(NH4+)=c(NH3•H2O),滴定未达到终点,此时溶液呈碱性,故图象中b点符合,
故答案为:b.
点评 本题考查无机物的推断,丙与酸、碱反应为解答的突破口,熟练掌握中学常见能与酸、碱反应的物质,(2)中注意理解滴定原理,题目难度中等.

| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | |||||
| 4 | ⑩ |
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是${\;}_{6}^{14}$C.
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是KOH.酸性最强的化合物的化学式是HClO4.
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式NH3+HNO3=NH4NO3.
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
| A. | 原子最外层电子数:Z>X=R>Y | |
| B. | Z与R形成的化合物中R显正价 | |
| C. | 离子半径:X2->Y+>R2->Z- | |
| D. | 四种元素中X元素形成的氢化物沸点最低 |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
| A. | 1.0 L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2N0 | |
| B. | 常温常压下,8gO2含有4 N0个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 | |
| D. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 N0 |
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$ mol的H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl2气体的摩尔质量为70 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
 .
. 片段
片段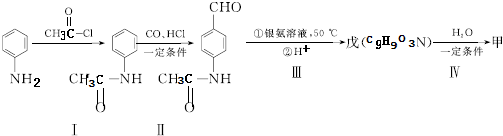
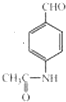 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$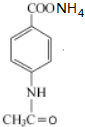 +3NH3+2Ag+H2O.
+3NH3+2Ag+H2O.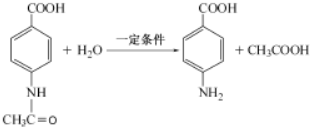 .
.