题目内容
3.N0为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 1.0 L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2N0 | |
| B. | 常温常压下,8gO2含有4 N0个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 | |
| D. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 N0 |
分析 A、在偏铝酸钠溶液中,除了偏铝酸钠外,水也含氧原子;
B、求出氧气的物质的量,然后根据1mol氧气中含16mol电子来分析;
C、溶液体积不明确;
D、羟基不显电性.
解答 解:A、在偏铝酸钠溶液中,除了偏铝酸钠外,水也含氧原子,故溶液中含有的氧原子的个数大于2No个,故A错误;
B、8g氧气的物质的量为0.25mol,而1mol氧气中含16mol电子,故0.25mol氧气中含4N0个电子,故B正确;
C、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故C错误;
D、羟基不显电性,故1mol羟基中含9N0个电子,而氢氧根中含10个电子,故1mol氢氧根中含10NO个电子,故错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.2mol Cu(OH)2后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解),则电解过程中转移电子的物质的量为( )
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
8.下列说法中不正确的是( )
| A. | 锂、钠、钾、铷、铯都具有碱性,故称为碱金属 | |
| B. | 石灰石、纯碱、小苏打、碳酸铵热稳定性最强的是纯碱 | |
| C. | 过氧化钠投入到饱和碳酸钠溶液既能产生白色沉淀,又能产生气体 | |
| D. | 金属Li是密度最小的碱金属,熔点大于Rb |
15.分子式为C9H10O2,能与NaHCO3溶液反应放出CO2气体,且苯环上的一氯代物有两种的有机物有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
12.下列说法中正确的是( )
| A. | NO2、SO2、BF3、NCl3分子中各原子均不满足最外层8电子结构 | |
| B. | 某化合物的焰色反应为黄色,则该化合物一定为钠盐 | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有6个 | |
| D. | 单质的晶体中一定不存在的微粒是阴离子 |
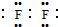 ;
;
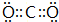 ,其中②原子的杂化方式为sp.
,其中②原子的杂化方式为sp.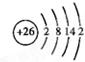 ,⑪原子的价电子排布式是4s24p3
,⑪原子的价电子排布式是4s24p3 由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,存在转化关系:甲$\stackrel{强酸溶液}{←}$丙$\stackrel{强碱溶液}{→}$乙
由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,存在转化关系:甲$\stackrel{强酸溶液}{←}$丙$\stackrel{强碱溶液}{→}$乙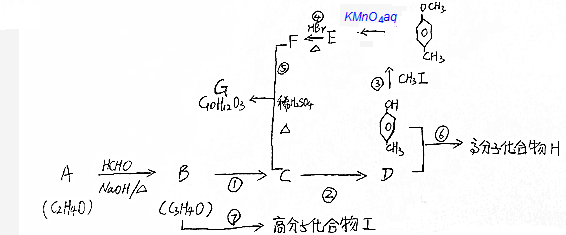

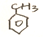 $\stackrel{KMnO_{4}aq}{→}$
$\stackrel{KMnO_{4}aq}{→}$
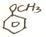 $→_{△}^{HBr}$
$→_{△}^{HBr}$ 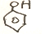
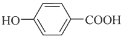 +CH3CH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH2CH2OH$→_{△}^{浓硫酸}$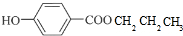 +H2O
+H2O