题目内容
下列叙述正确的是( )
| A、c(H+)等于1×10-7 mol/L的溶液一定是中性溶液 |
| B、任何浓度的溶液都可以用pH来表示其酸性的强弱 |
| C、无论是纯水、酸性、碱性或中性稀溶液,常温下,其c(H+)?c(OH-)=1×10-14 |
| D、0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍 |
考点:弱电解质在水溶液中的电离平衡,探究溶液的酸碱性
专题:
分析:A、溶液的酸碱性取决于氢离子浓度和氢氧根离子浓度的相对大小,c(H+)>c(OH-)溶液呈酸性,c(H+)=c(OH-)溶液呈中性,c(H+)<c(OH-)溶液呈碱性;
B、只有物质的量浓度小于1mol/L的用pH来表示其酸性的强弱;
C、水的离子积常数只与温度有关,与溶液的酸碱性无关;
D、根据醋酸浓度增大,电离程度减小进行分析.
B、只有物质的量浓度小于1mol/L的用pH来表示其酸性的强弱;
C、水的离子积常数只与温度有关,与溶液的酸碱性无关;
D、根据醋酸浓度增大,电离程度减小进行分析.
解答:
解:A、溶液的酸碱性取决于氢离子浓度和氢氧根离子浓度的相对大小,与溶液中氢离子浓度大小无关,所以c(H+)等于1×10-7mol/L的溶液不一定是中性溶液,故A错误;
B、当溶液的物质的量浓度大于1mol/L时,用物质的量浓度记录比用pH方便,所以不是任何浓度的溶液都可以用pH来表示其酸性的强弱,故B错误.
C、水的离子积常数只与温度有关,与溶液的酸碱性无关,在常温下,其c(H+)×c(OH-)=1×10-14,故C正确;
D、醋酸是弱电解质,浓度增大,醋酸的电离程度减小,所以0.2 mol/L CH3COOH溶液中的[H+]小于0.1 mol/L CH3COOH溶液中的[H+]的2倍,故D错误;
故选C.
B、当溶液的物质的量浓度大于1mol/L时,用物质的量浓度记录比用pH方便,所以不是任何浓度的溶液都可以用pH来表示其酸性的强弱,故B错误.
C、水的离子积常数只与温度有关,与溶液的酸碱性无关,在常温下,其c(H+)×c(OH-)=1×10-14,故C正确;
D、醋酸是弱电解质,浓度增大,醋酸的电离程度减小,所以0.2 mol/L CH3COOH溶液中的[H+]小于0.1 mol/L CH3COOH溶液中的[H+]的2倍,故D错误;
故选C.
点评:本题考查了溶液酸碱性的判断、水的离子积常数等知识点,注意溶液的酸碱性取决于氢离子浓度和氢氧根离子浓度的相对大小,与溶液中氢离子浓度大小无关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则下列表示R原子的符号中,正确的是( )
| A、abR |
| B、a+ba+2R |
| C、a+b-2a+2R |
| D、a+b-2a-2R |
将Mg、Cu组成的3.96g混合物投入适量稀硝酸中恰好反应,固体完全溶解时,得到唯一的还原产物NO气体1.344L(标准状况),向反应后溶液中加入2mol?L-1NaOH溶液至金属离子恰好沉淀完全.则消耗的NaOH溶液的体积为( )
| A、60mL | B、90mL |
| C、120mL | D、150mL |
下列说法正确的是( )
| A、2p和3p轨道形状均为哑铃形,能量也相等 |
| B、M层有3个能级,9个轨道 |
| C、第四周期最外层电子数为1,且内层电子全部排满的原子是钾原子 |
| D、在离核最近区域内运动的电子能量最高 |
下列事实不能用勒夏特列原理解释的是( )
| A、用排饱和食盐水法收集Cl2 |
| B、增大压强有利于合成氨反应 |
| C、加入催化剂有利于氨的转化 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g) |
已知Fe(OH)3胶体微粒能吸附Fe3+离子.将制得的Fe(OH)3胶体装入半透膜袋中,并浸没在盛有蒸馏水的烧杯中.隔一段时间后,烧杯里的水中含有的离子最多的是( )
| A、H+、OH- |
| B、H+、Cl- |
| C、Fe3+、Cl- |
| D、Fe3+、OH- |
化学是一门实用的、中心的学科,如果运用不当也会产生负面的影响.下列有关叙述不正确的是( )
| A、次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 |
| B、废旧电池会对生态环境和公众健康造成危害,所以废旧电池必须回收再利用 |
| C、明矾常用作净水剂,但人体摄入大量铝盐,易患“老年性痴呆症”,所以饮用水不能大量采用明矾作净水剂 |
| D、氟氯烃是制冷效果极佳的致冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品 |
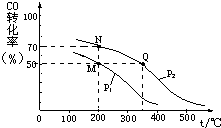 开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:
开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇: 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.