题目内容
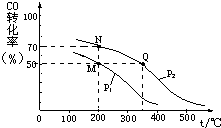 开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:
开发新能源和三废处理都是可持续发展的重要方面.CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).在密闭容器中充有10mol CO与20
mol H2,CO的平衡转化率与温度、压强的关系如图所示.
(1)M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总=
(2)若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为:P1
考点:转化率随温度、压强的变化曲线
专题:
分析:(1)M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为80%,参加反应的n(CO)=10mol×80%=8mol,还剩余2molCO,根据方程式知,还剩余n(H2)=20mol-8mol×2=4mol,生成n(CH3OH)=8mol,据此计算其物质的量之比;
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大.
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大.
解答:
解:(1)M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为80%,参加反应的n(CO)=10mol×80%=8mol,还剩余2molCO,根据方程式知,还剩余n(H2)=20mol-8mol×2=4mol,生成n(CH3OH)=8mol,所以容器中总物质的物质的量之比为:n(M)总:n(N)总=(5+10+5)mol:(2+4+8)mol=10:7,
故答案为:10:7;
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,
故答案为:KM=KN>KQ;<.
故答案为:10:7;
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,
故答案为:KM=KN>KQ;<.
点评:本题考查转化率与温度、压强关系,明确温度、压强对该反应平衡影响是解本题关键,题目难度中等.

练习册系列答案
相关题目
用盐酸测定碳酸钠时既可用酚酞作指示剂又可用甲基橙(一种酸碱指示剂)作指示剂,现分别用酚酞和甲基橙作指示剂,用0.1000mol/L的HCl滴定20.00mL的纯碱溶液,滴定终点时分别用去了20.00mL、40.00mL的盐酸,下列说法中不正确的是( )
| A、用酚酞作指示剂时滴定的总反应为:Na2CO3+HCl═NaHCO3+NaCl |
| B、用甲基橙作指示剂时滴定的总反应为:Na2CO3+2HCl═NaCl+CO2↑+H2O |
| C、可用碱式滴定管量取所需要的Na2CO3溶液 |
| D、若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏低 |
有一关于实验操作的谜语:“我入水中较安全,水入我中真危险,我与水合多放热,实验牢记保平安.”这一实验操作是指( )
| A、蔗糖溶于水中 |
| B、氢氧化钠溶于水 |
| C、用压强计测某一深度处的水压 |
| D、稀释浓硫酸 |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、酸与碱恰好完全反应生成正盐的溶液 |
| C、使石蕊试液呈紫色的溶液 |
| D、c(H+)=c(OH-)=10-6mol/L溶液 |
关于杂化轨道的说法不正确的是( )
| A、原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道 |
| B、杂化轨道的数目与杂化前的轨道数目可以相等,也可以不等 |
| C、杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理 |
| D、杂化轨道只能用于形成σ键或容纳孤电子对 |
下列叙述正确的是( )
| A、c(H+)等于1×10-7 mol/L的溶液一定是中性溶液 |
| B、任何浓度的溶液都可以用pH来表示其酸性的强弱 |
| C、无论是纯水、酸性、碱性或中性稀溶液,常温下,其c(H+)?c(OH-)=1×10-14 |
| D、0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍 |
下列叙述错误的是( )
| A、用金属钠可区分乙醇和乙醚 |
| B、用高锰酸钾酸性溶液可区分乙烷和乙烯 |
| C、用水可区分苯和甲苯 |
| D、用碳酸氢钠可以区分乙酸和乙醇 |