题目内容
下列离子方程式中,正确的是( )
| A、明矾净水原理:Al3++3H2O=Al(OH)3↓+3H+ |
| B、向偏铝酸钠溶液中通入少量的CO2气体 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向澄清石灰水中滴加盐酸 Ca(OH)2+2H+=Ca2++2H2O |
| D、向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
考点:离子方程式的书写
专题:
分析:A.盐类水解是少量的可逆过程,应该用可逆号,不标沉淀符号;
B.二氧化碳少量,碳酸氢根离子的酸性大于偏铝酸根离子,反应生成碳酸根离子;
C.澄清石灰水中的氢氧化钙,在离子方程式中应该拆开,不能保留化学式;
D.氢氧化钠过量,碳酸氢根离子完全转化成碳酸根离子,反应产物中碳酸根离子过量.
B.二氧化碳少量,碳酸氢根离子的酸性大于偏铝酸根离子,反应生成碳酸根离子;
C.澄清石灰水中的氢氧化钙,在离子方程式中应该拆开,不能保留化学式;
D.氢氧化钠过量,碳酸氢根离子完全转化成碳酸根离子,反应产物中碳酸根离子过量.
解答:
解:A.明矾净水的原理为:Al3++3H2O?Al(OH)3+3H+,故A错误;
B.向偏铝酸钠溶液中通入少量的CO2气体,反应生成氢氧化铝沉淀和碳酸根离子,正确的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故B错误;
C.向澄清石灰水中滴加盐酸,氢氧化钙应该拆开,正确的离子方程式为:OH-+H+=H2O,故C错误;
D.碳酸氢钙溶液中加入过量的氢氧化钠溶液,反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故D正确;
故选D.
B.向偏铝酸钠溶液中通入少量的CO2气体,反应生成氢氧化铝沉淀和碳酸根离子,正确的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故B错误;
C.向澄清石灰水中滴加盐酸,氢氧化钙应该拆开,正确的离子方程式为:OH-+H+=H2O,故C错误;
D.碳酸氢钙溶液中加入过量的氢氧化钠溶液,反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故D正确;
故选D.
点评:本题考查离子反应方程式的书写判断,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,A为易错点,注意盐类水解是微弱的应该用可逆号,不能用沉淀符号.

练习册系列答案
相关题目
2011年11月1日凌晨,“神舟八号”飞船成功发射升空,开启了与“天宫一号”交会对接之旅.宇宙飞船用镍钛合金制成自展天线,能在低温下被折叠,在阳光照射下可重新展开,关于此天线制作材料的描述错误的是( )
| A、具有形状记忆功能 |
| B、具有很低的熔点 |
| C、具有良好的延展性 |
| D、具有良好的导电性 |
下列各图中,表示正反应是吸热反应的图是( )
A、 |
B、 |
C、 |
D、 |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、1 mol AlCl3在熔融状态时离子总数为0.4NA |
| B、标准状况下,2.24L苯中含有的C-H键的数目为0.6NA |
| C、2.2g分子式为 2H218O的水中含有的中子数为1.2 NA |
| D、电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA |
设阿伏加德罗常数为NA,则下列说法正确的是( )
| A、11.2LNH3中含有的氢原子数为1.5NA |
| B、0.2mol/L的NaAlO2溶液含有0.2NA个Al3+ |
| C、常温常压下,18g水的原子数为3NA |
| D、32gO2与O3的混合物含有分子数为NA |
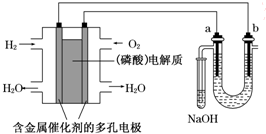 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )| A、电池工作时,正极反应式为:O2+2H2O+4e-═4OH- |
| B、电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、忽略能量损耗,当电池中消耗0.2 g H2时,b极周围会产生2.24L H2 |
 可逆反应mA(s)+nB(g) pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是( )
可逆反应mA(s)+nB(g) pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是( )| A、m+n<p |
| B、n>p |
| C、X点时v(正)>v(逆) |
| D、X点比Y点的正反应速率快 |
 下图为教材铝热反应演示实验示意图
下图为教材铝热反应演示实验示意图