题目内容
设阿伏加德罗常数为NA,则下列说法正确的是( )
| A、11.2LNH3中含有的氢原子数为1.5NA |
| B、0.2mol/L的NaAlO2溶液含有0.2NA个Al3+ |
| C、常温常压下,18g水的原子数为3NA |
| D、32gO2与O3的混合物含有分子数为NA |
考点:阿伏加德罗常数
专题:
分析:A、氨气所处的状态不明确;
B、NaAlO2中不含铝离子;
C、求出水的物质的量n=
,然后根据1mol水中含3mol原子来分析;
D、O2与O3的摩尔质量分别为32g/mol和48g/mol.
B、NaAlO2中不含铝离子;
C、求出水的物质的量n=
| m |
| M |
D、O2与O3的摩尔质量分别为32g/mol和48g/mol.
解答:
解:A、氨气所处的状态不明确,故物质的量不明确,含有的氢原子的物质的量不能计算,故A错误;
B、NaAlO2中不含铝离子,故B错误;
C、18g水的物质的量n=
=
=1mol,而1mol水中含3mol原子,故C正确;
D、O2与O3的摩尔质量分别为32g/mol和48g/mol,若32g全部是氧气,则物质的量n=
=
=1mol,分子数为NA;,若32g全部是臭氧,则物质的量n=
=
=
mol,分子数为
NA,故32gO2与O3的混合气体中含分子数介于NA-
NA,故D错误.
故选C.
B、NaAlO2中不含铝离子,故B错误;
C、18g水的物质的量n=
| m |
| M |
| 18g |
| 18g/mol |
D、O2与O3的摩尔质量分别为32g/mol和48g/mol,若32g全部是氧气,则物质的量n=
| m |
| M |
| 32g |
| 32g/mol |
| m |
| M |
| 32g |
| 48g/mol |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体.向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应,则下列分析正确的是( )
氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体.向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应,则下列分析正确的是( )| A、该区域是A,该区域中AgCl的直径最小 |
| B、该区域是B,该区域中AgCl的直径介于A、C区域之间 |
| C、该区域是C,该区域中AgCl的直径最大 |
| D、各区域AgCl的大小都相同,但只有B区域中分散质的大小介于1~100 nm之间 |
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,16 g CH4中含有的原子总数为5NA |
| B、标准状况下,11.2 LCH3OH中含有的共价键数目为2.5NA |
| C、常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| D、标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2NA |
下列离子方程式中,正确的是( )
| A、明矾净水原理:Al3++3H2O=Al(OH)3↓+3H+ |
| B、向偏铝酸钠溶液中通入少量的CO2气体 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向澄清石灰水中滴加盐酸 Ca(OH)2+2H+=Ca2++2H2O |
| D、向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
汽油燃烧产生的汽车尾气中,所含的大气污染物主要是( )
| A、碳的氧化物 |
| B、硫的氧化物 |
| C、氮的氧化物 |
| D、磷的氧化物 |
化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
| A、绿色化学的核心是应用化学原理对环境污染进行治理 |
| B、海水中存在大量镁单质 |
| C、大力推广燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 |
| D、计算机芯片的材料是二氧化硅 |
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 kJ?mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 kJ?mol-1表示.请认真观察下图,然后回答问题. 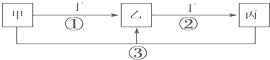 已知甲、乙、丙、丁是中学化学的常见物质,且甲、乙、丙均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知甲、乙、丙、丁是中学化学的常见物质,且甲、乙、丙均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).