题目内容
19.下列叙述正确的是( )| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 金属元素和非金属元素不可能形成共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中可能有共价键 |
分析 A.非金属原子间以共价键结合的物质可能是单质;
B.金属元素和非金属元素可以形成共价化合物;
C.共价化合物也可能电离出离子;
D.离子化合物中一定含有离子键,可能含有共价键.
解答 解:A.非金属原子间以共价键结合的物质可能是单质,如氧气、氢气等,故A错误;
B.金属元素和非金属元素可以形成共价化合物,如AlCl3,故B错误;
C.共价化合物也可能电离出离子,如硫酸在水中电离出氢离子和硫酸根离子,故C错误;
D.离子化合物中一定含有离子键,可能含有共价键,如KOH等,故D正确;
故选D.
点评 本题考查化学键和物质的关系,明确物质构成微粒及微粒之间作用力是解本题关键,注意不能根据是否含有金属元素判断离子键,注意规律中的反常现象,易错选项是B.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
4.下列指定反应的离子方程式正确的是( )
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+ |
7.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
14.某粒子用${\;}_Z^A{X^{n-}}$表示,下列关于该粒子的叙述错误的是( )
| A. | 质子数=A-n | B. | 中子数=A-Z | C. | 电子数=Z+n | D. | 所带电荷数=n |
4.下列反应的离子方程式书写正确的是( )
| A. | (NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH-=NH3•H2O | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 用烧碱溶液吸收氯气:Cl2+OH-=Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- |
11.某课外活动小组为探究金属与浓硫酸反应,进行了如下实验.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示.(固定装置已略去)
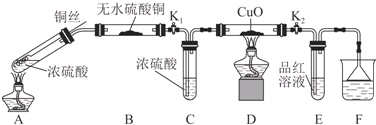
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
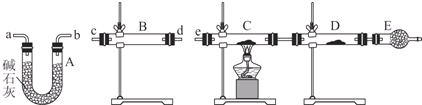
(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
①无水硫酸铜
②固体由白色变成蓝色
③SO2中含有水蒸气
④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色
⑤SO2中含有氢气.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示.(固定装置已略去)

(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).

(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
②固体由白色变成蓝色
③SO2中含有水蒸气
④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色
⑤SO2中含有氢气.
8.某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的原电池组成是( )
| A. | 正极为铜,负极为铁,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
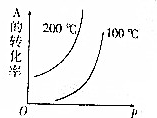 对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答: