题目内容
13. 根据图填空:
根据图填空:(1)反应物是A、B;生成物是C.
(2)该反应的化学方程式是3A+2B?3C.
分析 (1)图象分析可知AB浓度减小,C浓度增大,说明AB为反应物,C为生成物;
(2)分析图象可知反应AB和生成C的物质的量之比等于化学方程式计量数之比得到化学方程式.
解答 解:(1)图象分析可知AB浓度减小,C浓度增大,说明AB为反应物,C为生成物;
故答案为:A、B; C;
(2)图象分析A消耗浓度8mol/L-2mol/L=6mol/L,B消耗浓度=8mol/L-4mol/L=4mol/L,C生成浓度6mol/L,浓度之比等于物质的量之比,等于化学方程式计量数之比:n(A):n(B):n(C)=6:4:6=3:2:3,反应的化学方程式为:3A+2B?3C;
故答案为:3A+2B?3C.
点评 本题考查了化学平衡的分析计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
3.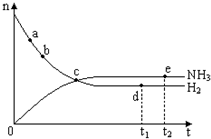 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,573K下反应至t1时刻,n(H2)比图中d点的值大 |
4.100mL6mol/LH2SO4跟过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量.加入下列物质不能达到上述目的是( )
| A. | 把锌粉改为锌粒 | B. | 水 | ||
| C. | 碳酸钠(固体) | D. | 降低反应体系温度 |
1.A~H均为短周期元素,A~F在元素周期表中的相对位置如图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素.由B、G组成的气态化合物甲水溶液呈碱性.
请回答下列问题:
(1)写出甲的电子式 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
a.离子键 b.极性键 c.非极性键
(3)请用电子式表示AE2的形成过程 .
.
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.
| A | B | C | |
| D | E | F |
(1)写出甲的电子式
 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
a.离子键 b.极性键 c.非极性键
(3)请用电子式表示AE2的形成过程
 .
.(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.
8.下列说法不正确的是( )
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 胶体中分散质微粒能透过滤纸不能透过半透膜 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
 研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题: