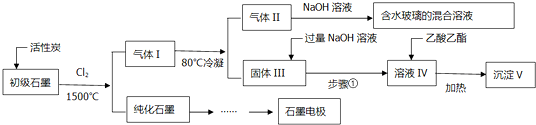
题目内容
2.应用化学反应原理知识解决下列问题:(1)写出一水合氨的电离方程式NH3.H2O?NH4++OH-.
(2)Fe2(SO4)3溶液显酸性的原因是(用离子方程式表示)Fe3++3H2O?Fe(OH)3+3H+,配制Fe2(SO4)3溶液时,为防止其水解,常往溶液中加少量稀硫酸(填序号).
①HCl ②NaCl ③H2SO4 ④NaOH
(3)一定条件下22g二氧化碳气体与足量氢气反应生成气态甲醇(CH3OH)和液态水时,放出250kJ热量,其反应的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(l )△H=-500kJ•mol-1.
(4)现有浓度为0.1mol•L-1的五种电解质溶液
①Na2CO3 ②NH4Cl ③Ba(OH)2 ④NaHCO3 ⑤HCl
这五种溶液的pH由小到大的顺序是⑤<②<④<①<③(填编号).
分析 (1)一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子;
(2)硫酸铁是强酸弱碱盐,铁离子水解导致溶液呈酸性,要抑制铁离子水解,可以向溶液中加入少量酸;
(3)计算1mol二氧化碳和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;
(4)电解质溶液:①Na2CO3 溶液中碳酸根离子水解显碱性,②NH4Cl 溶液中铵根离子水解显酸性,③Ba(OH)2 是强碱溶液,④NaHCO3 溶液中碳酸氢根离子水解显碱性⑤HCl是强酸溶液;依据阴离子水解程度分析判断.
解答 解:(1)一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子,电离方程式为NH3.H2O?NH4++OH-,
故答案为:NH3.H2O?NH4++OH-;
(2)硫酸铁是强酸弱碱盐,铁离子水解导致溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+,要抑制铁离子水解且不引进新的杂质离子,可以向溶液中加入少量稀硫酸,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;稀硫酸;
(3)22g CO2气体完全合成CH3OH和液态水时,放出250kJ热量,则1mol CO2完全合成CH3OH和液态水放热500kJ,热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(l )△H=-500kJ•mol-1,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(l )△H=-500kJ•mol-1;
(4)电解质溶液:①Na2CO3 溶液中碳酸根离子水解显碱性,②NH4Cl 溶液中铵根离子水解显酸性,③Ba(OH)2 是强碱溶液,④NaHCO3 溶液中碳酸氢根离子水解显碱性⑤HCl是强酸溶液;酸性:HCl大于氯化铵溶液,碱性:Ba(OH)2 大于Na2CO3 溶液,碳酸钠的水解程度大于碳酸氢钠,所以碱性:碳酸钠溶液大于碳酸氢钠,则溶液的pH由小到大的顺序是:⑤<②<④<①<③;
故答案为:⑤<②<④<①<③.
点评 本题考查弱电解质的电离、盐类的水解、及热化学方程式书写等知识点,题目难度中等,掌握盐类水解的实质和应用、弱电解质的电离,注意盐溶液的碱性强弱取决于阴离子的水解能力.

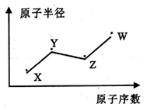 X、Y、Z、W是四种常.见的短周期主族元素,其原子半径随原子序数的变化如图所示,己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常.见的短周期主族元素,其原子半径随原子序数的变化如图所示,己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | B. | Y、W的最简单氢化物能相互反应 | ||
| C. | 非金属性:Z<Y | D. | X、Z、W形成的化合物均为强酸 |
| A. | 3mol C+1mol D | |
| B. | 1mol A+0.5mol B+1.5mol C+0.5mol D | |
| C. | 1mol A+0.5mol B+1.5mol C | |
| D. | 4mol A+2mol B |
| A. | NaCl溶液中滴加AgNO3溶液 | B. | Na2CO3溶液中滴加盐酸 | ||
| C. | CH3COOH溶液中滴加氨水 | D. | CuSO4溶液中滴加Ba(OH)2溶液 |
| 现象 | 解释或结论 | |
| A | 无色试剂瓶中的浓硝酸呈现黄色 | 硝酸不稳定,分解生成NO2的溶解在其中 |
| B | 在玻璃导管口点燃氢气,火焰呈黄色 | 氢气燃烧 |
| C | 某无色溶液中滴加氯水和四氯化碳,振荡、静置,下层出现紫色 | 溶液中含有碘离子 |
| D | 向CuSO4溶液中通入H2S,有黑色沉淀生成 | 有难溶的CuS生成 |
| A. | A | B. | B | C. | C | D. | D |
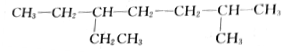 的名称是2-甲基-5-乙基庚烷
的名称是2-甲基-5-乙基庚烷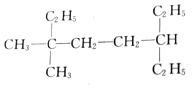 的名称是3,3-二甲基-6-乙基辛烷
的名称是3,3-二甲基-6-乙基辛烷 的名称是2-甲基-3,6-二乙基辛烷
的名称是2-甲基-3,6-二乙基辛烷 的名称是2,4,4,5-四甲基庚烷.
的名称是2,4,4,5-四甲基庚烷.