题目内容
11.几种短周期元素的原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化 合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | Y的非金属性大于S,其含氧酸酸性一定强于H2SO4 | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | X、Z、M的单质分别与水反应,M最剧烈 | |
| D. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
分析 X、Y、Z和M均为第三周期元素.由化合价关系可知X为Na元素,Y为Cl元素,Z为Al元素,M为Mg元素,Q只有-2价,应为O元素,R有+5价,且原子半径与O相近,应为N元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:X、Y、Z和M均为第三周期元素.由化合价关系可知X为Na元素,Y为Cl元素,Z为Al元素,M为Mg元素,Q只有-2价,应为O元素,R有+5价,且原子半径与O相近,应为N元素,
A.Y的非金属性大于S,如不是最高价含氧酸,则酸性不一定比硫酸强,如HClO为弱酸,故A错误;
B.如O和Na形成Na2O2,则含有共价键,故B错误;
C.Na的金属性最强,与水反应最剧烈,故C错误;
D.Z为Al,对应的氢氧化铝为两性氢氧化物,含有强碱、强酸反应,故D正确.
故选D.
点评 本题考查元素位置结构和性质的关系及应用,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某元素原子最外层有2个电子,关于此元素的说法一定正确的是( )
| A. | ⅡA族元素 | |
| B. | 可能是金属元素,也可能是非金属元素 | |
| C. | 金属元素 | |
| D. | ⅡA族或ⅡB族元素 |
19.有下列3组有机物,①乙烯、苯、甲苯;②乙醇、乙酸、乙酸乙酯;③油脂、蛋白质、纤维素.根据你学过的知识,你认为下列说法错误的是( )
| A. | ①中有机物均可以发生还原反应 | |
| B. | ②中有机物可用饱和Na2CO3溶液鉴别 | |
| C. | ③中有机物均可以发生水解反应 | |
| D. | ③中有机物均属于高分子化合物 |
6.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].常温下,在AG=-10的溶液中能大量共存的离子是( )
| A. | Ba2+、K+、Cl-、SO32- | B. | Na+、SiO32-、AlO2-、SO42- | ||
| C. | Na+、K+、HCO3-、S2- | D. | K+、NH4+、Fe3+、I- |
3.下列化学用语正确的是( )
| A. | CO2的结构式为O=C=O | B. | 乙烯的结构简式是C2H4 | ||
| C. | NaCl的电子式是Na:Cl: | D. | S原子的结构示意图: |
20.下列物质可以大量的随身携带乘车、船或飞机的是( )
| A. | 白磷 | B. | 浓硫酸 | C. | 加碘盐 | D. | 烟花爆竹 |
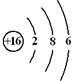 ,电子式表示化合物 C2D 的形成过程
,电子式表示化合物 C2D 的形成过程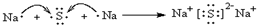 ;
;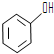 和
和 ,应选用a(填字母).
,应选用a(填字母).