题目内容
15.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法不正确的是( )| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定没有乙烯 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中可能含有C3H4 |
分析 n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和0.2molH2O,由原子守恒可知烃中平均C原子为$\frac{0.16mol}{0.1mol}$=1.6,平均H原子数为$\frac{0.2mol×2}{0.1mol}$=4,以此来解答.
解答 解:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和0.2molH2O,由原子守恒可知烃中平均C原子为$\frac{0.16mol}{0.1mol}$=1.6,平均H原子数为$\frac{0.2mol×2}{0.1mol}$=4,烃的平均组成为C1.6H4,则混合烃中一定含甲烷,可能含乙烯、丙炔等,一定没有乙烷,
故选B.
点评 本题考查有机物分子式的确定,为高频考点,把握原子守恒、平均组成法为解答的关键,侧重分析与计算能力的考查,注意有机物燃烧规律、烃的组成,题目难度不大.

练习册系列答案
相关题目
5.合金是常用的材料.下列产品不属于合金制品的是( )
| A. | 铁锅 | B. | 金属门窗 | C. | 不锈钢餐具 | D. | 水银温度计 |
6.下列电离方程式,书写正确的是( )
| A. | FeCl3═Fe3++Cl3- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | KMnO4═K++Mn7++4O2- |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 酸性溶液中:Ca2+、Na+、PO43-、NO3- | |
| B. | 0.1 mol•L-1Na2S溶液中:Ag+、Fe3+、NO3-、Cl- | |
| C. | 无色溶液中:K+、H+、Cl-、MnO4- | |
| D. | 0.1 mol•L-1 NaOH溶液中:K+、Na+、SO42-、CO32- |
10.下列离子检验的方法正确的是( )
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中一定含有Cl- | |
| B. | 某溶液先加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中一定含有SO42- | |
| C. | 某无色溶液滴入酚酞显红色,该溶液中一定含有大量的H+ | |
| D. | 某溶液中滴加稀硫酸生成无色气体,说明原溶液中一定含有CO32- |
5.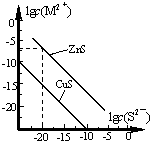 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
12.一定温度下,Mg(OH)2固体在水中达到沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq).要使Mg(OH)2固体质量减少而[Mg2+]不变,采取的措施可能是( )
| A. | 加适量水 | B. | 通HCl气体 | C. | 加NaOH固体 | D. | 加MgSO4 固体 |
9.CO2和H2可用于合成甲醇和甲醚.
(1)已知①CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③H2O(g)═H2O(l)△H=-44kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见表:
①下列关于上述可逆反应的说法正确的是AD
A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态
B.当v正(CO2)=3v逆(H2),反应达平衡状态
C.当n(CO2):n(H2)=1:3时,反应达平衡状态
D.a>60%
②上述反应的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$.
③该反应的△H<0,原因是由表中数据可判断b<55%,可得温度升高,反应物转化率降低,所以正反应放热.
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为60%,混合气体中CO2的体积分数为$\frac{4}{19}$.
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为CH3OH-8e-+8OH-=CO32-+6H2O.
(1)已知①CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③H2O(g)═H2O(l)△H=-44kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见表:
| 温度 转化率 压强 | 500K | 600K |
| P | 60% | b |
| 1.5P | a | 55% |
A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态
B.当v正(CO2)=3v逆(H2),反应达平衡状态
C.当n(CO2):n(H2)=1:3时,反应达平衡状态
D.a>60%
②上述反应的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$.
③该反应的△H<0,原因是由表中数据可判断b<55%,可得温度升高,反应物转化率降低,所以正反应放热.
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为60%,混合气体中CO2的体积分数为$\frac{4}{19}$.
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为CH3OH-8e-+8OH-=CO32-+6H2O.
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.