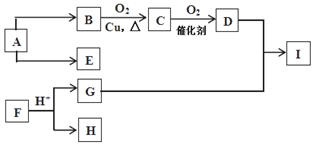
题目内容
2.根据要求回答下列问题:(1)制取MgCl2的过程中涉及反应:MgCl2•6H2O $\frac{\underline{\;△\;}}{\;}$MgCl2+6H2O,该反应要在HCl气氛中进行,原因是防止MgCl2水解.
(2)在实验室模拟氯碱工业电解饱和食盐水,用玻璃棒蘸浓氨水检验阳极产生的气体,生成大量白烟.写出化学方程式3Cl2+8NH3=N2+6NH4Cl.直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,写出相应的化学方程式:NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑,下列措施能增强“84”消毒液杀菌能力的是ad(填序号)
A.加入适量醋酸 b.加入适量亚硫酸c.加入少量NaOH粉末 d.加入适量的稀盐酸
(3)生活中常用ClO2净化自来水,将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂和还原剂的物质的量之比为2:1.有效氯含量可以来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.NaClO2的有效氯含量为2.6(结果保留小数点后1位).
(4)某学习小组探究过氧化钠和二氧化硫的化学反应,有同学认为类似于过氧化钠和二氧化碳的反应,有同学认为二氧化硫全被氧化,现向过氧化钠中通入足量的二氧化硫,请设计实验证明二氧化硫部分被氧化:取反应后的固体少许于试管中,加水溶解,先加足量盐酸,有刺激性气味气体放出,证明有SO32-存在,再加BaCl2溶液有白色沉淀,证明有SO42-存在,故二氧化硫部分氧化.
分析 (1)氯化镁失水发生水解生成氢氧化镁沉淀,为防止水解应在氯化氢气流中加热脱水;
(2)生成大量白烟,产生固体小颗粒氯化铵,反应的方程式为:3Cl2+8NH3=N2+6NH4Cl;“84”消毒液,所得消毒液仅含一种溶质是次氯酸钠,氯元素由原来的-1价变+1价,化合价升高,发生氧化反应,所以阴极氢离子发生还原反应生成氢气,反应的方程式为:NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑;根据强酸制弱酸和氧化还原的知识,如果生成次氯酸,就会增强“84”消毒液杀菌能力;
(3)将SO2通入硫酸酸化的KClO3可以制备ClO2,二氧化硫中的硫由+4价升高成+6价是还原剂,氯酸钾中的氯由+5价变成+4价,是氧化剂,根据得失电子守恒可知,氯酸钾前面的系数为2,而二氧化硫前面的系数是1,所以氧化剂和还原剂的物质的量之比为2:1;1gClO2的物质的量$\frac{1g}{67.5g/mol}$=$\frac{1}{67.5}$mol,依据电子转移数目相等,ClO2~Cl-~5e-,Cl2~2Cl-~2e-,可知氯气的物质的量为$\frac{1}{67.5}$mol×5×$\frac{1}{2}$=$\frac{5}{135}$mol,则氯气的质量为$\frac{5}{135}$mol×71g/mol=2.63g;
(4)所得固体混合物滴加盐酸产生刺激气味的气体,说明有亚硫酸根离子的存在,白色固体是否含有Na2SO4,依据硫酸根离子的检验方法设计实验验证,取反应后的适量白色固体溶于水,然后加入足量的盐酸溶液,最后在加入足量的BaCl2溶液,若有白色沉淀产生.
解答 解:(1)氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl2水解);
故答案为:防止MgCl2水解;
(2)生成大量白烟,产生固体小颗粒氯化铵,反应的方程式为:3Cl2+8NH3=N2+6NH4Cl;“84”消毒液,所得消毒液仅含一种溶质是次氯酸钠,氯元素由原来的-1价变+1价,化合价升高,发生氧化反应,所以阴极氢离子发生还原反应生成氢气,反应的方程式为:NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑;根据强酸制弱酸和氧化还原的知识,如果生成次氯酸,就会增强“84”消毒液杀菌能力,
a.加入适量醋酸,醋酸的酸性强次氯酸,所以生成次氯酸,漂白性增强,故正确;
b.加入适量亚硫酸,与次氯酸钠发生氧化还原反应,生成氯离子,消毒液杀菌能力减弱,故错误;
c.加入少量NaOH粉末,抑制水解,消毒液杀菌能力减弱,故错误;
d.加入适量的稀盐酸,生成次氯酸,漂白性增强,故正确;
故答案为:3Cl2+8NH3=N2+6NH4Cl;NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑; ad;
(3)将SO2通入硫酸酸化的KClO3可以制备ClO2,二氧化硫中的硫由+4价升高成+6价是还原剂,氯酸钾中的氯由+5价变成+4价,是氧化剂,根据得失电子守恒可知,氯酸钾前面的系数为2,而二氧化硫前面的系数是1,所以氧化剂和还原剂的物质的量之比为2:1;1gClO2的物质的量$\frac{1g}{67.5g/mol}$=$\frac{1}{67.5}$mol,依据电子转移数目相等,ClO2~Cl-~5e-,Cl2~2Cl-~2e-,可知氯气的物质的量为$\frac{1}{67.5}$mol×5×$\frac{1}{2}$=$\frac{5}{135}$mol,则氯气的质量为$\frac{5}{135}$mol×71g/mol=2.63g,保留小数点后1位所以2.6g,故答案为:2:1;2.6;
(4)所得固体混合物滴加盐酸产生刺激气味的气体,说明有亚硫酸根离子的存在,白色固体是否含有Na2SO4,依据硫酸根离子的检验方法设计实验验证,取反应后的适量白色固体溶于水,然后加入足量的盐酸溶液,最后在加入足量的BaCl2溶液,若有白色沉淀产生,即说明Na2SO4含有,
故答案为:取反应后的固体少许于试管中,加水溶解,先加足量盐酸,有刺激性气味气体放出,证明有SO32-存在,再加BaCl2溶液有白色沉淀,证明有SO42-存在,故二氧化硫部分氧化.
点评 本题考查了物质性质的实验探究方法和盐的水解,主要是次氯酸的强氧化性,硫酸根离子检验,掌握基础是关键,题目难度中等.

| A. | 瓜皮果壳-可回收垃圾 | B. | 医疗垃圾-危险废物 | ||
| C. | 玻璃制品-不可回收垃圾 | D. | 塑料-不可回收垃圾 |
| A. | 电子只能在电子云轮廓图中运动 | |
| B. | 能层不同,电子云轮廓图形状不相同 | |
| C. | 轨道数目相同,电子云轮廓图形状、大小完全相同 | |
| D. | 能层不同,能级相同,电子云轮廓图形状相同 |
| A. | 使pH试纸变蓝的溶液中:Fe3+、NH4+、S2-、SO32- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Ba2+、Al3+、Br- | |
| C. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ | |
| D. | 由水电离出的c(H+)=1×10-13 mol/L的溶液:K+、AlO2-、Br-、Cl- |
| A. | C5H12O的醇有8种结构 | B. | 分子式为C4H8的链烃有2种 | ||
| C. | C4H8O2的酯有4种结构 | D. | C9H12含苯环的烃有8种 |
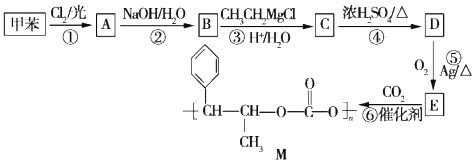
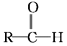 +R′-MgX→
+R′-MgX→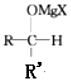 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$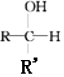 (R,R'均为烃基);
(R,R'均为烃基);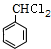 ,D
,D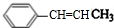 ,E
,E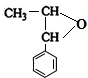 .
. .B与新制的Cu(OH)2悬浊液共热反应
.B与新制的Cu(OH)2悬浊液共热反应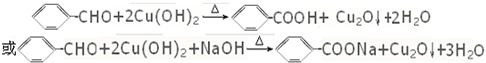 .
.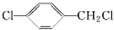 (填结构简式).
(填结构简式).