题目内容
12.完成以下化学反应的方程式:①钠与水反应:2Na+2H2O=2NaOH+H2↑
该反应中,氧化剂为H2O,还原产物为H2.
②过氧化钠与水的反应:2Na2O2+2H2O=4NaOH+O2↑
③氯气与水的反应:Cl2+H2O=HCl+HClO.
分析 ①钠与水反应生成氢氧化钠和氢气,依据反应中各元素化合价变化判断氧化剂和还原产物;
②过氧化钠与水反应生成氢氧化钠与氧气;
③氯气与水反应生成氯化氢和次氯酸.
解答 解:①钠与水反应生成氢氧化钠和氢气,方程式:2Na+2H2O=2NaOH+H2↑,反应中钠元素化合价升高,所以钠为还原剂对应氢氧化钠为氧化产物,水中+1加的氢化合价降低被还原,水为氧化剂,对应产物氢气为还原产物;
故答案为:Na+2H2O=2NaOH+H2↑; H2O;H2;
②过氧化钠与水的反应生成氢氧化钠与氧气,反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑;
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
③氯气与水反应生成氯化氢和次氯酸,反应的化学方程式:Cl2+H2O=HCl+HClO;
故答案为:Cl2+H2O=HCl+HClO.
点评 本题考查了化学方程式的书写,氧化还原反应基本概念判断,明确反应实质,准确判断元素化合价变化是解题关键,题目难度不大.

练习册系列答案
相关题目
9.下列有关物质的分类正确的是( )
| A. | 混合物:水玻璃、碱石灰、明矾 | B. | 酸:稀硫酸、次氯酸、硫酸氢钠 | ||
| C. | 酸性氧化物:SO2、CO2、SiO2 | D. | 碱性氧化物:CaO、Na2O2、K2O |
3.铁元素是高中化学中重要的金属元素,也是日常生活中不可缺少的重要元素.在高中学习中了解了铁及其化合物的性质与用途.某中学化学兴趣小组对Fe2+与Fe3+有关性质非常感兴趣,做了如下实验.
(1)探究Fe2+与Fe3+性质
请你用离子方程式和必要的文字解释实验3现象的原因MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,Fe2+具有还原性,MnO4-被还原生成了无色的Mn2+.请你描述实验4中空格的实验现象是先生成白色沉淀,一会儿变成灰绿色,最后成红褐色沉淀.
(2)甲兴趣小组对0.1mol•L-1Fe2+与0.1mol•L-1Fe3+的鉴别做了如下实验,现象记录如下:
①根据上表信息,你可以得到结论是(任写两条):当浓度为0.1mol•L-1,上述四种溶液可以鉴别Fe2+、Fe3+、当浓度为0.01mol•L-1,只能用KSCN溶液、10%NaOH溶液来鉴别Fe2+、Fe3+;离子浓度不同,鉴别试剂的选择也不同.
②有同学认为,除了上述试剂可用来鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,还有一种更为简单方法,请猜测这位同学的方法是观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色.
(3)乙兴趣小组认为可以用KI淀粉试纸鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,请你简述操作方法取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+,但乙组在做此实验时,都失败了(试剂没有变质,也没有杂质).你认为失败的原因是KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝.
(4)丙兴趣小组针对0.001mol•L-1Fe2+与0.001mol•L-1Fe3+无法用试剂来鉴别,他们想通过煮沸,蒸发溶剂,提高溶质的浓度来达到目的,你认为不行(行或不行)理由是在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+.
(1)探究Fe2+与Fe3+性质
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
(2)甲兴趣小组对0.1mol•L-1Fe2+与0.1mol•L-1Fe3+的鉴别做了如下实验,现象记录如下:
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
②有同学认为,除了上述试剂可用来鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,还有一种更为简单方法,请猜测这位同学的方法是观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色.
(3)乙兴趣小组认为可以用KI淀粉试纸鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,请你简述操作方法取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+,但乙组在做此实验时,都失败了(试剂没有变质,也没有杂质).你认为失败的原因是KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝.
(4)丙兴趣小组针对0.001mol•L-1Fe2+与0.001mol•L-1Fe3+无法用试剂来鉴别,他们想通过煮沸,蒸发溶剂,提高溶质的浓度来达到目的,你认为不行(行或不行)理由是在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+.
20.己知:60℃时,KNO3的溶解度为110g.在此温度下,向盛有l00mL水的烧杯中投入101g KNO3后充分搅拌,此烧杯中将会得到( )
| A. | 悬浊液 | B. | 饱和溶液 | ||
| C. | 质量分数约为50%的溶液 | D. | 物质的量浓度为10mol/L的溶液 |
7.下列反应中不属于可逆反应的是( )
| A. | 氮气和氢气的化合 | B. | 氯气溶于水 | ||
| C. | 氨气溶于水 | D. | 水的电解 |
4.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 27 mL 4℃的水中所含分子数约为1.5 NA个 | |
| B. | 电解精炼铜时,阳极减少6.4 g,则转移电子数一定是0.2 NA个 | |
| C. | 标准状况下,22.4L乙烯中共价键数目为8 NA | |
| D. | pH=1的硫酸溶液所含的H+数为NA个 |
1.设NA代表阿伏加德罗常数的数值.则下列有关叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数2 NA | |
| B. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| C. | 7.8g过氧化钠用于呼吸面具中完全反应时转移电子总数为0.1 NA | |
| D. | 将1L 2mol/L的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA |
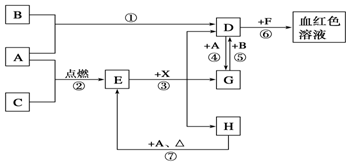 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).