题目内容
7.下列各组离子在给定条件下一定能大量共存的是( )| A. | 使pH试纸变蓝的溶液中:Fe3+、NH4+、S2-、SO32- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Ba2+、Al3+、Br- | |
| C. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ | |
| D. | 由水电离出的c(H+)=1×10-13 mol/L的溶液:K+、AlO2-、Br-、Cl- |
分析 A.使pH试纸变蓝的溶液,显碱性;
B.能与Al反应产生H2的溶液,为非氧化性酸或强碱溶液;
C.pH=1的溶液,显酸性;
D.由水电离出的c(H+)=1×10-13 mol/L的溶液,为酸或碱溶液.
解答 解:A.使pH试纸变蓝的溶液,显碱性,不能大量存在Fe3+、NH4+,且Fe3+分别与S2-、SO32-发生氧化还原反应,不能共存,故A不选;
B.能与Al反应产生H2的溶液,为非氧化性酸或强碱溶液,酸性溶液中不能大量存在HCO3-,碱性溶液不能大量存在HCO3-、Al3+,且HCO3-、Al3+相互促进水解,不能共存,故B不选;
C.pH=1的溶液,显酸性,该组离子之间不反应,可大量共存,故C选;
D.由水电离出的c(H+)=1×10-13 mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在AlO2-,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应、水解反应的判断,题目难度不大.

练习册系列答案
相关题目
18.下列关于化学与环境的叙述中错误的是( )
| A. | 燃煤时鼓入过量的空气可以减少酸雨的产生 | |
| B. | 利用汽车尾气催化装置可将尾气中的NO和CO转化为无害气体 | |
| C. | “煤改气”、“煤改电”等工程有利于减少雾霾 | |
| D. | 工业废气排放之前必须回收处理以防污染大气 |
15.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 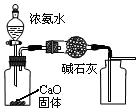 用图装置制取并收集干燥纯净的NH3 | |
| B. |  用图装置可以完成“喷泉”实验 | |
| C. |  用图装置直接测量Cu与浓硝酸反应产生的NO2体积 | |
| D. | 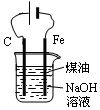 用图装置制备Fe(OH)2并能较长时间观察其颜色 |
12.下列实验操作中,正确且能达到目的是( )
| A. |  图是除去水中泥沙 | B. |  图是配制0.100 mol/L稀硫酸 | ||
| C. |  图是点燃酒精灯 | D. |  图是检查装置的气密性 |
19.下列热化学方程式中,正确的是( )
| A. | 已知:H2(g)+F2(g)═2HF(g)△H=-546.6 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2mol 液态氟化氢放出的热量小于546.6 kJ | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g) 置于密闭容器中充分反应生成NH3(g)放热19.3 kJ.其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4(aq)+Ca(OH)2(aq)═CaSO4(s)+2H2O(l)△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
17.下列说法正确的是( )
| A. | SiH4比CH4稳定 | |
| B. | P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | O2-半径比F-的小 |
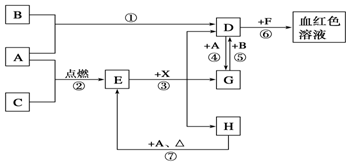 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).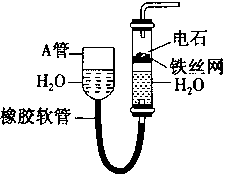 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空: