题目内容
19.下列说法不正确的是( )| A. | 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 | |
| B. | 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| D. | 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ |
分析 A.难溶物溶度积与温度有关,温度不变溶度积不变;
B.碳酸氢钾溶液溶液呈碱性,说明碳酸氢根离子的水解程度大于其电离程度;
C.c(Na+)>c(CN-),根据电荷守恒可知c(H+)<c(OH-),溶液呈碱性,结合a=b时分析;
D.氢氧化钠溶液抑制了水的电离,则由水电离出的c(H+)<$\sqrt{{K}_{W}}$.
解答 解:A.溶度积与温度有关,所以20℃时AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同,故A正确;
B.浓度为0.2mol/L的KHCO3溶液呈碱性,说明HCO3-的水解程度大于其电离程度,则c(H2CO3)>c(CO32-),故B正确;
C.a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),根据电荷守恒可知c(H+)<c(OH-),溶液呈碱性;当a=b时二者恰好反应生成强碱弱酸盐NaCN,所以当c(Na+)>c(CN-)时a不一定大于b,故C错误;
D.常温下纯水中由水电离出的c(H+)=c(OH-)=$\sqrt{{K}_{W}}$,由于KOH溶液抑制了水的电离,导致水的电离程度减小,则由水电离出的c(H+)<$\sqrt{{K}_{W}}$,故D正确;
故选C.
点评 本题考查较为综合,题目难度中等,涉及难溶物溶度积判断、盐的水解原理、酸碱混合的定性判断、水的电离及其影响等知识,注意掌握化学平衡及其影响,明确水的电离及其影响因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
10.表一是某种常见金属的部分性质:
表一:
将该金属投入到稀盐酸中,可产生大量的无色气体.根据上述信息回答下列问题:
(1)推断该金属的一种用途是做导线.
(2)该金属的活动性比铜强(填“强”或“弱”).
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱,并完成下表二:
表二:
表一:
| 颜色和状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g•cm-3 | 660.4℃ | 良好 | 良好 | 良好 |
(1)推断该金属的一种用途是做导线.
(2)该金属的活动性比铜强(填“强”或“弱”).
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱,并完成下表二:
表二:
| 一种猜想 | 验证方法 | 现象 | 结论 |
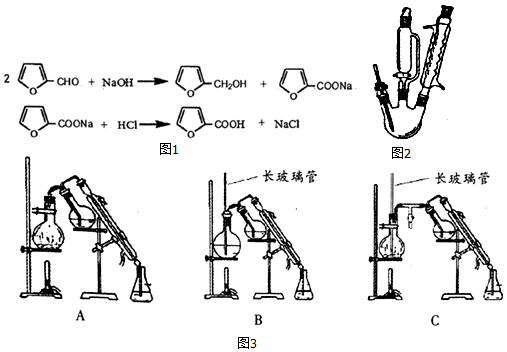
4.糠酸又称呋喃甲酸,在食品工业作防腐剂,还可用于合成树脂或医药、香料等的中 间体.以米槺或玉米芯提取的呋喃甲醛为原料合成糠酸反应如图1
几种有机物性质如表:
刚果红试纸pH变色范围:3.0(蓝紫色)~5.0(红色)
呋喃甲酸的实验室制备方法如图2:
三颈瓶中放人3.28mL(0.04mol)新蒸呋喃甲醛,控温8~12℃下滴加4mL40%NaOH溶液,并
磁力搅拌回流30分钟.向反应混合物滴加蒸馏水(约15mL)使其恰好澄清,用50mL乙醚萃取分液,其水溶液用水蒸气蒸馏,弃去镏出物,慢慢滴加2:1盐酸到pH=3,搅拌,析出结晶,抽滤并用少量水洗涤抽干,得精产品1.5g.
回答以下问题:
(1)三颈瓶中反应需要搅拌回流30分钟的原因是呋喃甲醛微溶于水,搅拌充分混合加快反应速率.
(2)呋喃甲醛在碱中反应大量放热,实验中需要控温8-12℃,其操作方法冷水浴.
(3)50mL乙醚萃取分液,除去呋喃甲醇的操作方法是C.
A、直接用50mL乙醚萃取分液
B、将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C、先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并
(4)乙醚提取后的水溶液要用盐酸酸化.配制100mL 2:1稀盐酸(水与盐酸体积比)的方法是用量筒分别量取66ml水、34ml浓盐酸,于烧杯中混合,用玻璃棒搅拌均匀;判断盐酸加入足量的方法是使用刚果红试纸测定溶液pH,当试纸变蓝紫色时,说明加入盐酸足量 (上层清液中继续滴加盐酸,不产生浑浊,说明盐酸加入足量).
(5)乙醚易挥发、易燃,蒸气可使人失去知觉,在蒸馏回收乙醚时注意:在水浴上进行蒸馏,切忌直接明火加热;水蒸气蒸馏的方法应选择(图3)C(填字母序号);
(6)计算呋喃甲酸的产率67%.
几种有机物性质如表:
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
呋喃甲酸的实验室制备方法如图2:
三颈瓶中放人3.28mL(0.04mol)新蒸呋喃甲醛,控温8~12℃下滴加4mL40%NaOH溶液,并
磁力搅拌回流30分钟.向反应混合物滴加蒸馏水(约15mL)使其恰好澄清,用50mL乙醚萃取分液,其水溶液用水蒸气蒸馏,弃去镏出物,慢慢滴加2:1盐酸到pH=3,搅拌,析出结晶,抽滤并用少量水洗涤抽干,得精产品1.5g.
回答以下问题:
(1)三颈瓶中反应需要搅拌回流30分钟的原因是呋喃甲醛微溶于水,搅拌充分混合加快反应速率.
(2)呋喃甲醛在碱中反应大量放热,实验中需要控温8-12℃,其操作方法冷水浴.
(3)50mL乙醚萃取分液,除去呋喃甲醇的操作方法是C.
A、直接用50mL乙醚萃取分液
B、将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C、先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并
(4)乙醚提取后的水溶液要用盐酸酸化.配制100mL 2:1稀盐酸(水与盐酸体积比)的方法是用量筒分别量取66ml水、34ml浓盐酸,于烧杯中混合,用玻璃棒搅拌均匀;判断盐酸加入足量的方法是使用刚果红试纸测定溶液pH,当试纸变蓝紫色时,说明加入盐酸足量 (上层清液中继续滴加盐酸,不产生浑浊,说明盐酸加入足量).
(5)乙醚易挥发、易燃,蒸气可使人失去知觉,在蒸馏回收乙醚时注意:在水浴上进行蒸馏,切忌直接明火加热;水蒸气蒸馏的方法应选择(图3)C(填字母序号);
(6)计算呋喃甲酸的产率67%.

11.我国预计在2020年前后建成自己的载人空间站.为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2.关于该装置的下列说法不正确的是( )
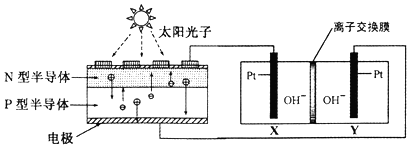

| A. | 图中N型半导体为负极,P型半导体为正极 | |
| B. | 图中离子交换膜为阴离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O=CO+2OH- |
8.磁黄铁矿(主要成分是Fe1-nS,S为-2价)导电性好,且略具磁性,主要用于提取硫、生产硫酸等.将mg该磁黄铁矿与200mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成硫单质4.8g、FeCl20.85mol和一定量H2S气体,向反应后的溶液中加入KSCN溶液无现象.下列说法正确的是( )
| A. | mg该磁黄铁矿中含+2价的铁0.75mol | |
| B. | 200mL盐酸中HCl物质的量浓度为4.25mol•L-1 | |
| C. | 生成的H2S气体在标准状况下的体积为16.8L | |
| D. | 该磁黄铁矿中Fe1-nS的n=0.15 |
8.将17克气体H2A通入水中形成500ml溶液,完全中和该二元酸用去NaOH 40克,则 下列说法正确的是( )
| A. | 该气体的摩尔质量为34 | B. | 500ml溶液物质的量浓度为2mol/L | ||
| C. | 标况下该气体的摩尔体积为22.4 L | D. | 17克该气体物质的量为0.5mol |