题目内容
8.将17克气体H2A通入水中形成500ml溶液,完全中和该二元酸用去NaOH 40克,则 下列说法正确的是( )| A. | 该气体的摩尔质量为34 | B. | 500ml溶液物质的量浓度为2mol/L | ||
| C. | 标况下该气体的摩尔体积为22.4 L | D. | 17克该气体物质的量为0.5mol |
分析 n(NaOH)=$\frac{40g}{40g/mol}$=1mol,H2A和NaOH以1:2进行反应,所以完全中和NaOH需要H2A物质的量为0.5mol,根据M=$\frac{m}{n}$、c=$\frac{n}{V}$结合物理量的单位进行分析解答.
解答 解:A.摩尔质量的单位是g/mol而不是“1”,故A错误;
B.H2A物质的量为0.5mol,则该溶液的物质的量浓度=$\frac{0.5mol}{0.5L}$=1mol/L,故B错误;
C.气体摩尔体积的单位是L/mol,而不是L,故C错误;
C.n(NaOH)=$\frac{40g}{40g/mol}$=1mol,H2A和NaOH以1:2进行反应,所以完全中和NaOH需要H2A物质的量为0.5mol,故D正确;
故选D.
点评 本题考查了物质的量的有关计算,灵活运用基本公式是解本题关键,注意基本物理量的单位,为易错点.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 | |
| B. | 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| D. | 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ |
20.在A、B两个烧杯的溶液中,共含有Fe2+、Na+、H+、NO3-、Cl-、OH-6种离子,已知B烧杯为无色溶液,含有大量的其中三种离子,则A烧杯的溶液中含有大量的另外三种离子是( )
| A. | NO3-、OH-、Na+ | B. | Fe2+、H+、Cl- | C. | Fe2+、OH-、NO3- | D. | Fe2+、H+、NO3- |
3.下列事实不能用化学平衡移动原理解释的是( )
| A. | 棕红色NO2加压后颜色先变深后变浅 | |
| B. | 加催化剂,使 N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和NaOH固体快速制取氨气 | |
| D. | 加压条件下有利于SO2与O2反应生成SO3 |
13.下列说法中正确的是( )
| A. | 乙烷和乙烯均可使酸性KMnO4溶液褪色 | |
| B. | 甲烷燃烧会生成CO2,因此不属于清洁能源 | |
| C. | 向甲苯中滴入少量浓溴水,振荡,静置,溶液分层,上层呈橙红色,下层几乎无色,可知甲苯和溴水发生取代反应,使溴水褪色 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
20.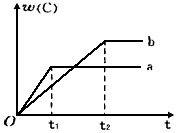 如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
 如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )| A. | 反应起始由逆反应开始建立平衡 | |
| B. | a表示有催化剂,b表示无催化剂 | |
| C. | 若n=2,其它条件相同,a比b的压强大 | |
| D. | 若其它条件相同,a比b的温度高 |
17.根据下列实验,所得实验现象和实验结论正确的是( )
| 实验 | 现象 | 实验结论 | |
| A | 将SO2气体通入紫色石蕊试液中 | 溶液先变红后褪色 | 二氧化硫具有酸性和漂白性 |
| B | 将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| D | 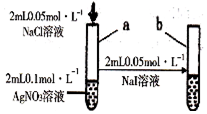 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
18.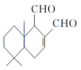 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )| A. | H2 | B. | Cu(OH)2悬浊液 | C. | HBr | D. | Br2的CCl4溶液 |
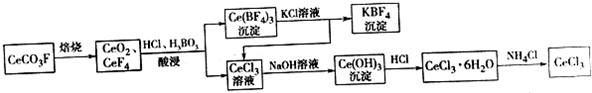
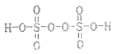 ,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-