题目内容
12.1mol的CO和1molCO2中所含O原子个数之比1:2,C原子个数之比1:1,总原子个数之比2:3,二者的质量之比7:11,在标准状况下的体积之比1:1.分析 1个CO含有1个C原子和1个O,1个CO2含有1个C和2个O,依据n=$\frac{m}{M}$=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$解答.
解答 解:1mol的CO含有1molO,1molC;1molCO2中含有2molO,1molC;原子个数之比等于原子物质的量之比,
所以1mol的CO和1molCO2中所含O原子个数之比1:2;
1mol的CO和1molCO2中C原子个数之比:1:1;
1mol的CO和1molCO2中总原子个数之比(1+1):(1+2)=2:3;
1mol的CO质量为1mol×28g/mol=28g;1molCO2质量为1mol×44g/mol=44g,二者质量之比为:28:44=7:11;
相同状况下,气体体积之比等于物质的量之比,所以1mol的CO和1molCO2在标准状况下的体积之比:1:1;
故答案为:1:2; 1:1;2:3;7:11;1:1.
点评 本题考查了物质的量的有关计算,熟悉以物质的量为核心的相关计算公式是解题关键,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
20.在沥青中有一系列稠环化合物,它们彼此虽不是同系物,但其组成和结构都有规律性的变化,从萘开始,这一系列化合物中第25个分子式是( )
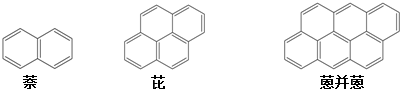

| A. | C50H30 | B. | C154H56 | C. | C154H60 | D. | C150H56 |
7.试预测下列哪些物质不具备漂白性( )
| A. | 氯水 | B. | (CaCl2)氯化钙溶液 | ||
| C. | 漂白粉溶液 | D. | (NaClO)次氯酸钠溶液 |
2.核磁共振(NMR)技术已经广泛应用于分子结构的测定等领域.已知只有质子数或中子数为奇数的原子核才有NMR现象,下列能产生NMR现象的原子是( )
| A. | 32 S | B. | 4 He | C. | 14 N | D. | 32 Si |