题目内容
一定温度下,向a mol?L-1 NaOH溶液中通入足量的二氧化碳,下列说法正确的是( )
| A、溶液中Kw减小 |
| B、溶液中的CO32-离子浓度一直增大 |
| C、微热反应后的溶液,溶液的pH会升高 |
| D、当恰好生成NaHCO3时,溶液中离子浓度大小存在以下关系:c(Na+)+c(H-)═c(HCO3)+c(OH-) |
考点:化学方程式的有关计算,离子浓度大小的比较,钠的重要化合物
专题:电离平衡与溶液的pH专题,元素及其化合物
分析:A.因为温度不变,所以Kw不变;
B.溶液中的CO32-离子浓度先增大,后减小;
C.反应后的溶液为碳酸氢钠溶液,碳酸氢钠为强碱弱酸盐,水解呈碱性,水解反应为吸热反应;
D.当恰好生成NaHCO3时,根据溶液呈电中性解答.
B.溶液中的CO32-离子浓度先增大,后减小;
C.反应后的溶液为碳酸氢钠溶液,碳酸氢钠为强碱弱酸盐,水解呈碱性,水解反应为吸热反应;
D.当恰好生成NaHCO3时,根据溶液呈电中性解答.
解答:
解:二氧化碳通入氢氧化钠溶液生成碳酸钠和水,反应的化学方程式是:CO2+2NaOH═Na2CO3+H2O,氢氧化钠和过量的二氧化碳反应生成碳酸氢钠NaOH+CO2=NaHCO3,
A.一定温度下,温度不变,水的离子积常数Kw不变,故A错误;
B.向a mol?L-1 NaOH溶液中通入足量的二氧化碳,先生成碳酸钠,后生成碳酸氢钠,所以溶液中的CO32-离子浓度先增大,后减小,故B错误;
C.反应后的溶液为碳酸氢钠溶液,碳酸氢钠为强碱弱酸盐,水解呈碱性,发生HCO3-+H2O?H2CO3+OH-,微热反应后的溶液,碳酸氢钠水解程度增大,碱性增强,故C正确;
D.当恰好生成NaHCO3时,根据溶液呈电中性,溶液中存在的电荷守恒关系是c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选C.
A.一定温度下,温度不变,水的离子积常数Kw不变,故A错误;
B.向a mol?L-1 NaOH溶液中通入足量的二氧化碳,先生成碳酸钠,后生成碳酸氢钠,所以溶液中的CO32-离子浓度先增大,后减小,故B错误;
C.反应后的溶液为碳酸氢钠溶液,碳酸氢钠为强碱弱酸盐,水解呈碱性,发生HCO3-+H2O?H2CO3+OH-,微热反应后的溶液,碳酸氢钠水解程度增大,碱性增强,故C正确;
D.当恰好生成NaHCO3时,根据溶液呈电中性,溶液中存在的电荷守恒关系是c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选C.
点评:本题主要考查盐类水解的应用,侧重于化学知识的综合运用的考查,注意把握盐类水解的原理,理解电荷守恒和物料守恒的运用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+1/2O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
| A、1molCH3OH完全燃烧放出热量192.9 kJ |
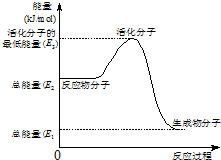
| B、②中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
现有CuO和Fe3O4组成的混合物mg,向其中加入2mol/L的稀HCl 100mL,恰好完全反应.若将mg该混合物在足量的H2中加热,使其充分反应后冷却,剩余固体的质量为( )
| A、(m+1.6)g |
| B、1.6m g |
| C、(m-3.2)g |
| D、(m-1.6)g |
下列实验方案合理的是( )
| A、配制50 g质量分数为5% NaCl溶液:将45 mL水加入到盛有5 g NaCl的烧杯中,搅拌溶解 |
B、 制备乙酸乙酯:用如图所示的实验装置 |
| C、鉴定SO42-:向溶液中加入盐酸酸化的氯化钡溶液 |
| D、鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中 |