题目内容
在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:(t-BuNO)2?2(t-BuNO).该温度下该反应在CCl4溶剂中的平衡常数为1.4.
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L).反应在前10min内的平均速率为ν(t-BuNO)= .列式计算上述反应的平衡常数K= .
(2)有关反应:(t-BuNO)2?2(t-BuNO) 的叙述正确的是
A.压强越大,反应物的转化率越大B.温度升高,该平衡一定向右移动C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线.
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L).反应在前10min内的平均速率为ν(t-BuNO)=
(2)有关反应:(t-BuNO)2?2(t-BuNO) 的叙述正确的是
A.压强越大,反应物的转化率越大B.温度升高,该平衡一定向右移动C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线.
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |

考点:化学平衡的计算
专题:化学平衡专题
分析:(1)用三段式法,求出△c可得v(t-BuNO);K也需三段式法求解.
(2)注意物质的状态,利用题给在CCl4中的K值和求得在正庚烷中的K值比较即可.
(3)画图时注意起点、拐点和终点,9min时反应达到平衡状态.
(2)注意物质的状态,利用题给在CCl4中的K值和求得在正庚烷中的K值比较即可.
(3)画图时注意起点、拐点和终点,9min时反应达到平衡状态.
解答:
解:(1)△n(t-BuNO)=0.50mol×60%×2=0.6mol,v(t-BuNO)=
=
=0.06mol?L-1?min-1
当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得平衡转化率(α)是60%,
则 (t-BuNO)2?2(t-BuNO)
开始浓度(mol?L-1) 0.5 0
转化浓度(mol?L-1) 0.5×60% 0.5×60%×2
平衡浓度(mol?L-1) 0.5×(1-60%) 0.5×60%×2
K=
=
=1.8mol/L
故答案为:0.06mol?L-1?min-1;1.8mol/L;
(2)A、因为该反应在溶液中进行,无气体参与反应,所以压强的变化对平衡移动无影响,故A错误;
B、不知道该反应是放热还是吸热,故B错误;
C、在CCl4溶剂中的平衡常数为1.4,在正庚烷中的K值为1.8,故C正确.
故选C;
(3)从表中数据可见,t-BuNO的浓度从0开始,9min时达到平衡,浓度变为0.096mol/L,(t-BuNO)2的浓度从0.05mol/L开始,9min时变为0.002mol/L达到平衡,平衡后,各自的浓度不再变化,如图所示: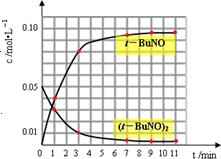 ,
,
故答案为: ;
;
| ||
| △t |
| ||
| 10min |
当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得平衡转化率(α)是60%,
则 (t-BuNO)2?2(t-BuNO)
开始浓度(mol?L-1) 0.5 0
转化浓度(mol?L-1) 0.5×60% 0.5×60%×2
平衡浓度(mol?L-1) 0.5×(1-60%) 0.5×60%×2
K=
| c2(t-BuNO) |
| c[(t-BuNO)2] |
| (0.6mol/L)2 |
| 0.2mol/L |
故答案为:0.06mol?L-1?min-1;1.8mol/L;
(2)A、因为该反应在溶液中进行,无气体参与反应,所以压强的变化对平衡移动无影响,故A错误;
B、不知道该反应是放热还是吸热,故B错误;
C、在CCl4溶剂中的平衡常数为1.4,在正庚烷中的K值为1.8,故C正确.
故选C;
(3)从表中数据可见,t-BuNO的浓度从0开始,9min时达到平衡,浓度变为0.096mol/L,(t-BuNO)2的浓度从0.05mol/L开始,9min时变为0.002mol/L达到平衡,平衡后,各自的浓度不再变化,如图所示:
 ,
,故答案为:
 ;
;
点评:本题考查全面,题目跨度大,主要是化学平衡计算,图象绘制方法,掌握基础是关键,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
一定温度下,向a mol?L-1 NaOH溶液中通入足量的二氧化碳,下列说法正确的是( )
| A、溶液中Kw减小 |
| B、溶液中的CO32-离子浓度一直增大 |
| C、微热反应后的溶液,溶液的pH会升高 |
| D、当恰好生成NaHCO3时,溶液中离子浓度大小存在以下关系:c(Na+)+c(H-)═c(HCO3)+c(OH-) |


