题目内容
现有CuO和Fe3O4组成的混合物mg,向其中加入2mol/L的稀HCl 100mL,恰好完全反应.若将mg该混合物在足量的H2中加热,使其充分反应后冷却,剩余固体的质量为( )
| A、(m+1.6)g |
| B、1.6m g |
| C、(m-3.2)g |
| D、(m-1.6)g |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:金属氧化物与盐酸反应生成盐和水,其中氧元素与HCl中氢元素结合生成水,则混合物中n(O)=
n(HCl),金属氧化物在足量的氢气中加热,最终剩余固体为Cu、Fe,由质量守恒,混合物的质量减去氧元素的质量即为金属的质量.
| 1 |
| 2 |
解答:
解:金属氧化物与盐酸反应生成盐和水,其中氧元素与HCl中氢元素结合生成水,则混合物中n(O)=
n(HCl)=0.1L×2mol/L×
=0.1mol,
金属氧化物在足量的氢气中加热,最终剩余固体为Cu、Fe,由质量守恒,则剩余固体质量为:ag-0.1mol×16g/mol=(a-1.6)g,
故选D.
| 1 |
| 2 |
| 1 |
| 2 |
金属氧化物在足量的氢气中加热,最终剩余固体为Cu、Fe,由质量守恒,则剩余固体质量为:ag-0.1mol×16g/mol=(a-1.6)g,
故选D.
点评:本题考查混合物的计算,难度中等,注意根据发生的反应利用守恒法进行解答,侧重考查学生分析思维能力与解题方法技巧的考查.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
向FeCl3和CuCl2混合液中加入过量的铁粉,反应完毕后,剩下的固体物质恰好跟加入的铁粉质量相等,则原混合液中FeCl3和CuCl2物质的量之比为( )
| A、2:7 | B、7:2 |
| C、1:7 | D、7:1 |
某金属M的硝酸盐受热时按下列方式发生分解反应:2MNO3
2M+2NO2↑+O2↑,加热3.40g该硝酸盐,完全分解生成NO2和O2共672mL(标准状况),则M的相对原子质量为( )
| ||
| A、23 | B、40 |
| C、108 | D、201 |
一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g.原混合气体中CO2的质量为( )
| A、12.5g |
| B、13.2g |
| C、19.7g |
| D、24.4g |
全轨电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)
VO2+(黄色)+V2+(绿色)+2H+下列说法错误的是( )
| 充电 |
| 放电 |
| A、充电时,阳极附近溶液由蓝色逐渐变为黄色 |
| B、放电过程中,正极附近溶液的酸性减弱 |
| C、充电时,反应每生成2mol H+时电子转移数为2mol |
| D、放电时,正极反应为VO2++2H++e-═VO2++H2O |
一定温度下,向a mol?L-1 NaOH溶液中通入足量的二氧化碳,下列说法正确的是( )
| A、溶液中Kw减小 |
| B、溶液中的CO32-离子浓度一直增大 |
| C、微热反应后的溶液,溶液的pH会升高 |
| D、当恰好生成NaHCO3时,溶液中离子浓度大小存在以下关系:c(Na+)+c(H-)═c(HCO3)+c(OH-) |
 影片《阿凡达》出现了一种潘多拉星球的宇宙飞船.右表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都是由该表中的元素组成)根据以上信息可推断下列说法正确的是( )
影片《阿凡达》出现了一种潘多拉星球的宇宙飞船.右表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都是由该表中的元素组成)根据以上信息可推断下列说法正确的是( )| A、e和f组成的化合物可吸收宇航员在宇宙飞船活动舱内产生的由d和f组成的气体 | ||||||||
| B、活动舱内还要营造一种适合宇航员生存的人工生态环境,如适当充入a和f组成的一种化合物 | ||||||||
| C、c和f以离子个数之比为2:1组成的化合物可用作宇航员所需f单质的来源 | ||||||||
D、若潘多拉星球上存在
|
甲烷中混有乙烯,欲除去乙烯,得到纯净的甲烷,最好依次通过的试剂瓶顺序是( )
| A、澄清石灰水、浓硫酸 |
| B、酸性高锰酸钾溶液、浓硫酸 |
| C、足量溴水、浓硫酸 |
| D、浓硫酸、酸性高锰酸钾 |
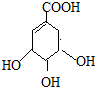 (提示:环丁烷
(提示:环丁烷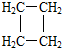 可简写成
可简写成 )
)