题目内容
铁及其化合物与生产、生活关系密切.
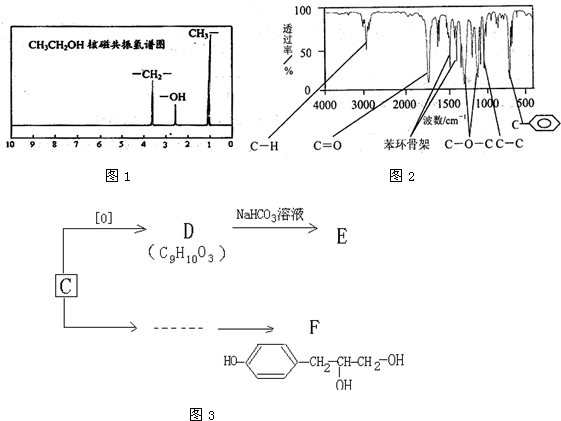
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
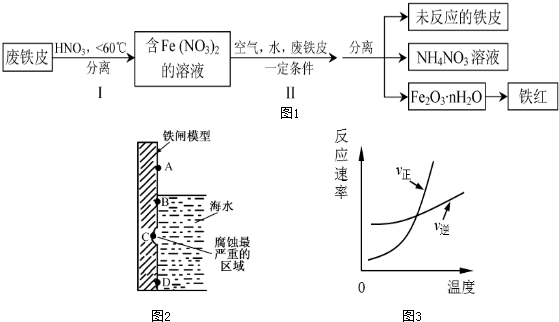
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3?nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .

(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释:
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3?nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式
考点:金属的回收与环境、资源保护,化学平衡建立的过程
专题:化学平衡专题,元素及其化合物
分析:(1)①由图可知,海水溶液为弱酸性,发生吸氧腐蚀,氧气具有强氧化性,充当氧化剂,被还原;
②A发生化学腐蚀,B发生电化学腐蚀,C已经腐蚀后有氧化层,D在金属内部;
(2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3?nH2O,最后得到铁红,
硝酸分解生成二氧化氮、氧气、水;产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,则Fe与硝酸反应生成硝酸亚铁、硝酸铵和水;氮氧化物为有毒气体;
(3)K=
,升高温度,V正增加的快,;
通入x mol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始 0.02 x 0 0
转化 0.01 0.01 0.01 0.01
平衡 x-0.01 0.01
结合化学反应速率计算.
②A发生化学腐蚀,B发生电化学腐蚀,C已经腐蚀后有氧化层,D在金属内部;
(2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3?nH2O,最后得到铁红,
硝酸分解生成二氧化氮、氧气、水;产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,则Fe与硝酸反应生成硝酸亚铁、硝酸铵和水;氮氧化物为有毒气体;
(3)K=
| c(CO2) |
| c(CO) |
通入x mol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始 0.02 x 0 0
转化 0.01 0.01 0.01 0.01
平衡 x-0.01 0.01
结合化学反应速率计算.
解答:
解:(1)由图可知,海水溶液为弱酸性,则Fe失去电子,正极上O2得到电子,发生吸氧腐蚀,A发生化学腐蚀,B发生电化学腐蚀,C已经腐蚀后有氧化层,D在金属内部,显然B中腐蚀速率最快,生成铁锈最多,故答案为:O2;B;
(2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3?nH2O,最后得到铁红;硝酸分解生成二氧化氮、氧气、水,该反应为4HNO3
4NO2↑+O2↑+2H2O,产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,则Fe与硝酸反应生成硝酸亚铁、硝酸铵和水,该反应为4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O,由流程可知,上述生产流程中,能体现“绿色化学”思想的是减少了有毒的氮氧化物的生成,氮氧化物排放少,
故答案为:4HNO3
4NO2↑+O2↑+2H2O,造成原料浪费;4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O;氮氧化物排放少;
(3)依据化学反应方程式得出:平衡常数K=
;升高温度,V正增加的快,故正反应为吸热反应;
t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始 0.02 0
转化 0.01 0.01
平衡 0.01
故v(CO2)=
=0.001mol/(L?min),故答案为:
;吸热;0.001mol/(L?min).
(2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3?nH2O,最后得到铁红;硝酸分解生成二氧化氮、氧气、水,该反应为4HNO3
| ||
故答案为:4HNO3
| ||
(3)依据化学反应方程式得出:平衡常数K=
| c(CO2) |
| c(CO) |
t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始 0.02 0
转化 0.01 0.01
平衡 0.01
故v(CO2)=
| ||
| 5min |
| c(CO2) |
| c(CO) |
点评:本题考查较综合,涉及化学平衡计算、电化学腐蚀及物质的制备流程等,为高频考点,侧重分析能力及计算能力的考查,把握化学反应原理及图象、流程的分析为解答的关键,题目难度中等.

练习册系列答案
相关题目
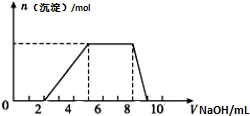 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比1:3 |
| D、原溶液中含有的阴离子是AlO2-、Cl- |
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )| A、1:1 | B、2:1 |
| C、3:2 | D、2:3 |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入200mL2.20mol/L盐酸中,充分反应后产生896mLH2(标准状况).残留固体1.28g.过滤、滤液中无Cu2+.将滤液加水稀释到500mL,测得其中c(H+)为0.160mol/L.已知Fe+Fe3+=3Fe2+,Cu+2Fe3+=2Fe2++Cu2+.则原混合物中单质铁的质量是( )
| A、2.4g |
| B、3.36g |
| C、5.60g |
| D、10.08g |
 如图是制取、干燥和收集某气体的实验装置,可用于( )
如图是制取、干燥和收集某气体的实验装置,可用于( )| A、用Zn与稀H2SO4反应制H2 |
| B、用CaO与浓氨水反应制NH3 |
| C、用Cu与稀HNO3反应制NO |
| D、用MnO2与浓HCl反应制C12 |
 X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.
X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.| A、①② | B、②③ | C、②④ | D、①④ |
下列说法正确的是( )
| A、将浓度为0.1 mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、25℃时,等体积、等pH的HCl、H2SO4、CH3COOH溶液分别与足量锌粉反应,H2SO4溶液产生的H2量最多 |
| C、Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,加入NaOH固体会使平衡逆向移动,溶液pH减小 |
| D、25℃时,pH均为8的CH3COONa和NaOH溶液中,由水电解产生的c(OH-)之比为100:1 |