题目内容
10.相同条件下,下列气体密度最大的是( )| A. | 氯气 | B. | 二氧化硫 | C. | 氮气 | D. | 氢气 |
分析 相同条件下,气体摩尔体积相等,根据ρ=$\frac{m}{V}$=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{V}_{m}}$中密度和摩尔质量之间的关系式计算.
解答 解:相同条件下,气体摩尔体积相等,根据ρ=$\frac{m}{V}$=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{V}_{m}}$中知,气体摩尔体积相等时,气体密度与其摩尔质量成正比,氯气的摩尔质量是71g/mol,二氧化硫的摩尔质量是64g/mol,氮气的摩尔质量是28g/mol,氢气的摩尔质量是2g/mol,摩尔质量越大其密度越大,所以密度大小顺序是:A>B>C>D,则摩尔质量最大的是氯气,
故选A.
点评 本题考查了阿伏伽德罗定律及推论,会根据各个物理量之间的关系来分析解答,从而得出密度和摩尔质量之间的关系,难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
3.“分子机器设计和合成”有着巨大的研究潜力.人类步入分子器件时代后,使得光控、温控和电控分子的能力更强,下图是蒽醌套索醚电控开关.下列说法错误的是( )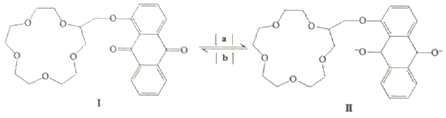

| A. | 物质Ⅰ的分子式是C25H28O8 | B. | 反应是氧化反应 | ||
| C. | 1molⅠ可与8molH2发生加成反应 | D. | 物质Ⅰ的所有原子不可能共平面 |
18.下列变化,需要加入适当的氧化剂才能完成的是( )
| A. | CuO→Cu | B. | Fe→FeCl2 | C. | H2SO4→CuSO4 | D. | HNO3→NO2 |
15.下列有关物质的用途中,运用了物质的化学性质的是( )
| A. | 用胶状氢氧化铝凝聚水中的悬浮物进行净水 | |
| B. | 用红棕色氧化铁制造红色油漆 | |
| C. | 氢氧化铝作为医用的胃酸中和剂 | |
| D. | 用氧化铝制造耐火坩埚和耐火管 |
2.(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为H2A=2H++A2-;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2一样多(填“多”、“少”或“一样多”).
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A-)<c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A-)=0.2mol/L.
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
①少量二氧化碳通入NaClO溶液中的离子方程式ClO-+CO2+H2O=HCO3-+HClO;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是b(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)-c( CH3COOH)=2(10-6-10-8)mol/L(填准确数值).
①H2A在水溶液中的电离方程式为H2A=2H++A2-;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2一样多(填“多”、“少”或“一样多”).
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A-)<c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A-)=0.2mol/L.
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是b(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)-c( CH3COOH)=2(10-6-10-8)mol/L(填准确数值).
1.以下变化明显吸热的是( )
| A. | 盐酸与NaOH溶液混合 | B. | 固体NaCl加入水中 | ||
| C. | 固体NH4Cl加入水中 | D. | 固体CaO加入水中 |