题目内容
1.SO2+2H2S=3S+2H2O 中,氧化剂是SO2,还原剂是H2S,氧化剂和还原剂物质的量之比为1:2,氧化产物和还原产物质量之比为2:1.分析 在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,H2S中S元素的化合价由-2升高到0,以此来解答.
解答 解:在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,为氧化剂;
H2S中S元素的化合价由-2升高到0,为还原剂,
氧化剂和还原剂物质的量之比为1:2,
由S原子守恒及反应可知,2mol还原剂反应生成氧化产物为2mol,1mol氧化剂反应生成还原产物为1mol,
所以氧化产物与还原产物的物质的量之比为2mol:1mol=2:1,
故答案为:SO2;H2S;1:2;2:1.
点评 本题考查氧化还原反应,为高频考点,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂、氧化产物与还原产物的关系来解答,难度不大.

练习册系列答案
相关题目
14.本届奥运会上多名运动员因兴奋剂检测呈阳性而使比赛成绩取消,如图是其中检测出的两种兴奋剂的结构:
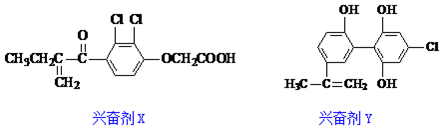
关于它们的说法中正确的是( )
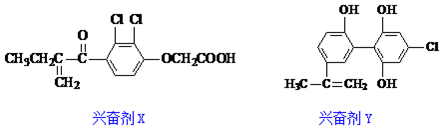
关于它们的说法中正确的是( )
| A. | Y遇到氯化铁溶液时显紫色,但不能使溴的四氯化碳溶液褪色 | |
| B. | X既可以发生氧化反应,又可以发生还原反应 | |
| C. | 1molX与足量氢气反应,最多可消耗6molH2 | |
| D. | 1molY分子中最多有8个碳原子共面 |
12.下列仪器名称为“分液漏斗”的是( )
| A. |  | B. |  | C. |  | D. |  |
9.硼元素的平均相对原子质量为10.8,则硼在自然界中的两种同位素${\;}_{\;}^{10}$B和B${\;}_{\;}^{11}$的原子个数比为( )
| A. | 1:4 | B. | 10:11 | C. | 4:1 | D. | 5:22 |
16.将下列各组物质按酸、碱、盐分类顺次排列,其中正确的是( )
| A. | 硫酸 纯碱 孔雀石 | B. | 硝酸 烧碱 明矾 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
6.氯元素的相对原子质量为35.5,已知自然界中氯有35Cl、37Cl两种同位素原子,其中37Cl占质量分数为( )
| A. | 75% | B. | >75% | C. | <75% | D. | 不能确定 |
13.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | Cl2 |
| A. | 表中①组的反应可能有一种或两种元素被氧化 | |
| B. | 氧化性哟弱的比较:KClO3>Fe3+>Br2>Cl2 | |
| C. | 表中③组反应的还原产物是KCl,电子转移数目是6e | |
| D. | 表中②组反应的化学方程式为:2KMnO4+3H2O2+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O |
10.相同条件下,下列气体密度最大的是( )
| A. | 氯气 | B. | 二氧化硫 | C. | 氮气 | D. | 氢气 |