题目内容
19.下列说法正确的是( )| A. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其反应速率 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,一段时间后,铝片表面都观察不到明显的反应现象 | |
| C. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| D. | 试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 |
分析 A.S为固体,不能用固体表示反应速率;
B.CuSO4和CuCl2溶液中铜离子水解,溶液显酸性,能先与氧化铝反应;
C.加热时,氯化钠的溶解度增大,应冷却结晶得到硝酸钾;
D.硫磺可以用热的KOH溶液来洗涤:3S+6KOH═K2SO3+2K2S+3H2O.
解答 解:A.S为固体,不能用固体表示反应速率,故A错误;
B.CuSO4和CuCl2溶液中铜离子水解,溶液显酸性,能先与氧化铝反应,去除氧化膜后,活泼的铝与酸反应会产生气体,同时铝也置换出铜,有红色物质析出,故B错误;
C.加热时,氯化钠的溶解度增大,但二者溶解度受温度影响不同,则应冷却结晶得到硝酸钾,故C错误;
D.硫磺可以用热的KOH溶液来洗涤:3S+6KOH═K2SO3+2K2S+3H2O,硫易溶于二硫化碳,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、反应速率的测定、物质的分离以及仪器的洗涤等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
13.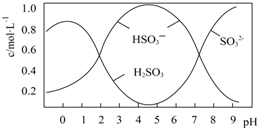 葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
 葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )| A. | Na2S2O5溶于水的化学方程式:Na2S2O5+H2O=2NaHSO3 | |
| B. | 由图形可知,25℃时,HSO3-的水解平衡常数约为10-12 | |
| C. | 当溶液pH小于0.5后,图中曲线变化的原因可能是H2SO3被部分氧化 | |
| D. | 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) |
10.下列实验原理、实验操作及结论正确的是( )
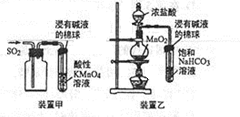

| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液,出现白色沉淀的为苏打溶液 | |
| D. | 向足量含淀粉的Fel2溶液中滴加2滴新制氯水,溶液变蓝,说明还原性:I->Fe2+ |
7.下列说法正确的是( )
| A. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| B. | 可采取加热蒸发的方法使FeCl3从水溶液中结晶析出 | |
| C. | NaAlO2浓液中滴加Na2C03溶液,有沉淀和气体生成 | |
| D. | 将SO2分别通入硝酸钡溶液和溶有氨气的氯化钡溶液中,产生沉淀的成分相同 |
14.下列说法不正确的是( )
| A. | C5H12有三种不同的结构,其中一种同分异构体的名称是2,2-二甲基丙烷 | |
| B. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 | |
| C. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| D. | 不同条件下,乙稀可与氧气反应生成乙醛、乙酸、环氧乙烷( ),这些反应都属于氧化反应 ),这些反应都属于氧化反应 |
4.下列说法不正确的是( )
| A. | 实验探究Zn-Cu及稀硫酸原电池工作原理,在稀硫酸溶液中加少量重铬酸钾因其有去极化作用可延长灯泡发亮时间,重铬酸钾也可用 KMnO4、MnO2等强氧化性物质代替 | |
| B. | 一些有机溶剂(如乙醚、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 | |
| C. | 在醋酸钠溶液中滴人酚酞试液,加热后红色加深,可证明盐类水解是吸热反应 | |
| D. | 可使用溴水鉴别植物油和汽油 |
11. 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10 mL时:c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 曲线Ⅱ:滴加溶液到20 mL时:2c(CH3COO-)+c(CH3COOH)+c(OH-)═2c(Na+)+c(H+) | |
| C. | 根据滴定曲线,可得Kb(NH3•H2O)≈10-13 | |
| D. | 由曲线Ⅱ可知,选用酚酞和选用甲基橙作指示剂,消耗NaOH溶液的体积相同 |
8.根据下列操作、现象,所得结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色. 后者为红褐色 | 温度升高,Fe3+的水解 程度增大 |
| B | NaOH的乙醇溶液与溴乙烷共热,产生的气体通入 酸性高锰酸钾溶液中 | 溶液褪色 | 产生的气体为乙烯 |
| C | 铜铝合金加入一定量稀硝酸中,有金属剩余,再加稀硫酸 | 剩余金属质量减小 | 铝与稀硫酸反应使 剩余金属质量减小 |
| D | 盛有NO2的集气瓶中加入一定量水 | 气体变为无色 | NO2是酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
9.晚唐诗人李商隐的《无题•相见时难别亦难》中写到“春蚕到死丝方尽,蜡炬成灰泪始干”,下列说法正确的是( )
| A. | 蚕丝属于纤维素 | |
| B. | 蜡烛的主要成分是石蜡,属于混合物 | |
| C. | “泪”是指石蜡燃烧生成的水 | |
| D. | 蚕丝和石蜡完全燃烧所得产物相同 |