题目内容
9.下列物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成)( )单质→氧化物→氧化物→酸或碱.
| A. | 氮 | B. | 钠 | C. | 硫 | D. | 硅 |
分析 氮、钠、硫均可发生连续氧化反应,只有硅不能发生连续氧化反应,以此来解答.
解答 解:A.N$\stackrel{{O}_{2}}{→}$NO$\stackrel{{O}_{2}}{→}$NO2$\stackrel{{H}_{2}O}{→}$HNO3,故A不选;
B.Na$\stackrel{{O}_{2}}{→}$Na2O$\stackrel{{O}_{2}}{→}$Na2O$\stackrel{{H}_{2}O}{→}$NaOH,故B不选;
C.$S\stackrel{{O}_{2}}{→}S{O}_{2}\stackrel{{O}_{2}}{→}S{O}_{3}\stackrel{{H}_{2}O}{→}{H}_{2}S{O}_{4}$,故C不选;
D.Si只能氧化为氧化硅,不能发生连续氧化反应,且氧化硅不能直接转化为酸或碱,故D选,
故选D.
点评 本题考查物质的转化,为高频考点,侧重元素化合物性质及转化的考查,把握连续氧化为解答的关键,注意直接转化的信息,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
19.下列各表述与示意图一致的是( )
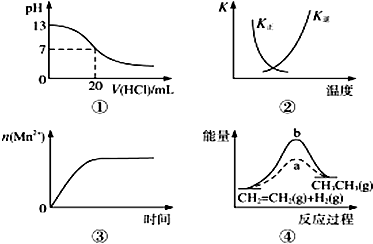

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的p随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
20.下列物质中互为同系物的是( )
| A. | 甲烷与丙烷 | B. | 乙醇与乙酸 | ||
| C. | 一氯甲烷与二氯甲烷 | D. | 正丁烷与异丁烷 |
14.NA代表阿伏加罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,60gCH3COOH中含共用电子对数为7NA | |
| B. | 56g聚乙烯含有的碳原子数为4NA | |
| C. | 2molSO2和1molO2在密闭容器中充分反应后,容器内物质分子数等于2NA | |
| D. | 2L0.5mol/L乙酸溶液中H原子数为0.1NA |
1.氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,则相对分子质量为70,72,74的氯气分子数之比可能是( )
| A. | 5:3:2 | B. | 5:2:3 | C. | 5:1:2 | D. | 9:6:1 |
19.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
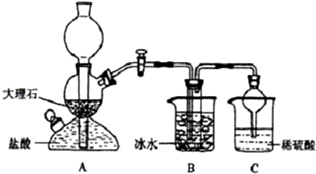
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为温度越低碳酸氢钠溶解度越小,便于析出.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液 的洗气装置,其作用是除去二氧化碳气体中的氯化氢气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.

(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液 的洗气装置,其作用是除去二氧化碳气体中的氯化氢气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
 .
.
 .
.