题目内容
6.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )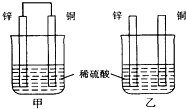
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.甲中铜为正极,乙中不构成原电池,铜片不是电极,B错误;
C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D错误;
故选C.
点评 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.

练习册系列答案
相关题目
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和C(金刚石) | B. | CO2和H2 | C. | NaCl和HCl | D. | MgCl2和KCl |
14.下列化合物中不含双键结构的是( )
| A. | 乙醇 | B. | 二氧化碳 | C. | 乙酸 | D. | 乙醛 |
1.将铁片插入下列溶液中,看不到反应现象的是( )
| A. | 稀硫酸 | B. | 稀盐酸 | C. | 硫酸铜 | D. | 浓硝酸 |
15.在一固定体积的密闭容器中加入2mol A和1mol B发生反应2A(g)+B(g)?4C(g)+D(s),达到平衡时C的浓度为w mol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol•L-1的配比是( )
| A. | 4 molA+2 molB | |
| B. | 4 mol C+1 molD+2mol A+1 mol B | |
| C. | 1.6mol C+0.3 molD+1.2mol A+0.6 mol B | |
| D. | 4 mol C+0.8molD |
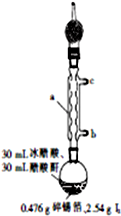 四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下: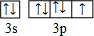 ,R基态原子的外围电子排布式为3d104s1.
,R基态原子的外围电子排布式为3d104s1.