题目内容
11.元素X、Y、Z、W、R为前四周期元素,且原子序数依次增大.已知:X原子核外s轨道电子数是p轨道电子数的2倍;Z原子L电子层上有2对成对电子;W原子核外电子占有9个轨道,而且有1个未成对电子;R为过渡金属,R+核外有3个电子层且各层均处于全满状态.请回答下列问题:(1)W基态原子的价电子排布图为
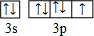 ,R基态原子的外围电子排布式为3d104s1.
,R基态原子的外围电子排布式为3d104s1.(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)C<O<N.
(3)由上述元素形成的与BF3互为等电子体的阴离子的化学式为NO3-、CO32-,其中心原子的杂化方式为sp2杂化.
(4)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无色;为d1~d9排布时,有颜色.据此判断,[R(H2O)6]2+有(填“无”或“有”)颜色.
(5)已知Z、R能形成两种化合物,其晶胞如图甲和乙所示,则甲的化学式为CuO,乙的化学式为;Cu2O;高温时甲易转化为乙,原因是Cu2O中Cu原子d轨道为全满状态,比较稳定.
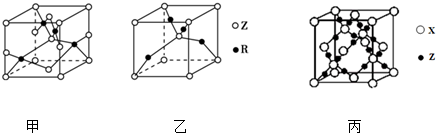
(6)在高温高压下,由X和Z两种元素所形成的晶体其晶胞如图丙所示,则该晶体的化学式为CO2(用元素符号表示).若该晶体中距离最近的两个X原子核之间的距离为a pm,则该晶体的密度为$\frac{44×8}{(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}×{N}_{A}}$g/cm3(写出含a的表达式,不必化简,用NA表示阿伏加德罗常数的值).
分析 元素X、Y、Z、W、R为前四周期元素,且原子序数依次增大.X原子核外s轨道电子数是p轨道电子数的2倍,原子核外电子排布式为1s22s22p2,则X为C元素;Z原子L电子层上有2对成对电子,原子核外电子排布式为1s22s22p4,则Z为O元素;Y的原子序数介于碳、氧之间,故Y为N元素;W原子核外电子占有9个轨道,而且有1个未成对电子,原子核外电子排布式为1s22s22p63s22p5,故W为Cl;R为过渡金属,R+核外有3个电子层且各层均处于全满状态,外围电子排布式为3d104s1,则W为Cu.
(1)W基态原子的价电子排布式为3s22p5,根据泡利原理、洪特规则画出电子排布图;根据核外电子排布规律书写R原子外围电子排布式;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
(3)原子数目相等、价电子总数也相邻的微粒互为等电子体;结合中心原子杂化轨道数目确定杂化方式;
(4)根据核外电子排布规律,书写Cu2+的核外电子排布式,据此结合题目信息“d轨道为d0或d10排布时,无颜色,为d1~d9排布时,有颜色”判断;
(5)根据均摊法计算晶胞中Cu、O原子数目确定化学式;根据洪特规则特例分析解答;
(6)利用均摊法计算晶胞中C、O原子数目确定化学式;
晶胞中体对角线上4个原子之间距离最近,则体对角线长度为4a pm,故晶胞棱长为$\frac{4a}{\sqrt{3}}$ pm,结合晶胞中原子数目表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算.
解答 解:元素X、Y、Z、W、R为前四周期元素,且原子序数依次增大.X原子核外s轨道电子数是p轨道电子数的2倍,原子核外电子排布式为1s22s22p2,则X为C元素;Z原子L电子层上有2对成对电子,原子核外电子排布式为1s22s22p4,则Z为O元素;Y的原子序数介于碳、氧之间,故Y为N元素;W原子核外电子占有9个轨道,而且有1个未成对电子,原子核外电子排布式为1s22s22p63s22p5,故W为Cl;R为过渡金属,R+核外有3个电子层且各层均处于全满状态,外围电子排布式为3d104s1,则W为Cu.
(1)W基态原子的价电子排布式为3s22p5,则电子排布图为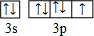 ,R为过渡金属,R+核外有3个电子层且各层均处于全满状态,外围电子排布式为3d104s1,
,R为过渡金属,R+核外有3个电子层且各层均处于全满状态,外围电子排布式为3d104s1,
故答案为: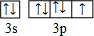 ;3d104s1;
;3d104s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能由小到大的顺序为:C<O<N,
故答案为:C<O<N;
(3)由上述元素形成的与BF3互为等电子体的阴离子的化学式为 NO3-、CO32-,中心原子均没有孤对电子,其中心原子的杂化轨道数目为3,杂化方式为 sp2杂化,
故答案为:NO3-、CO32-; sp2;
(4)Cu2+的核外电子排布式为1s22s22p63s23p63d9,d能级未排满电子,故[Cu(H2O)6]2+ 有颜色,故答案为:有;
(5)已知O、Cu能形成晶胞如图所示的两种化合物,甲中黑色球数目=4,白色球数目=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8×$\frac{1}{8}$=2,黑色球与白色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙,
故答案为:CuO;Cu2O;Cu2O中Cu原子d轨道为全满状态,比较稳定.
(6)晶胞中C原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧原子数目为8,故晶体的化学式为:CO2,
晶胞中体对角线上4个原子之间距离最近,则体对角线长度为4a pm,故晶胞棱长为$\frac{4a}{\sqrt{3}}$ pm,晶胞质量为4×$\frac{88}{{N}_{A}}$g,故晶体密度为4×$\frac{88}{{N}_{A}}$g÷($\frac{4a}{\sqrt{3}}$×10-10 cm)3=$\frac{44×8}{(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}×{N}_{A}}$g/cm3,
故答案为:CO2;$\frac{44×8}{(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}×{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、等电子体、杂化方式、晶胞计算等,(6)中计算为易错点、难点,故关键是距离确定最近的X原子计算晶胞棱长,需要学生具备一定的空间想象与数学计算能力.

| A. | 常温下,0.1mol•L-1的CH3COOH溶液中,由水电离出的c(H+)为1.0×10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液的pH<7 | |
| D. | 25℃时,完全中和50mLpH=3的H2SO4溶液,需要pH=11的NaOH溶液50mL |
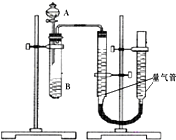 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(2)分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/ml | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4溶液过量.
| A. | O2和O3 | B. | 2H2和3H2 | ||
| C. | H2O与H2O2 | D. | C2H5COOH与CH3COOCH3 |
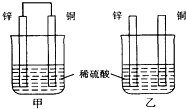
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
| A. | 该有机物仅含碳、氧两种元素 | |
| B. | 该有机物中碳、氧、氧原子个数比为1:4:2 | |
| C. | 无法确定是否含有氧元素 | |
| D. | 该有机物中一定含有氧元素 |
| A. | CH4和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、N2O | D. | H2O和CH4 |
 .
.