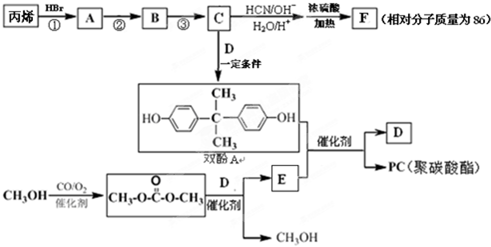
题目内容
4.下列各组物质性质比较中正确的是( )| A. | 常温常压下溶解度:CaCO3<Na2CO3<NaHCO3 | |
| B. | 氧化性:Mg2+<H+<Cu2+<Fe3+ | |
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO | |
| D. | 沸点:SiC>I2>Si>HF |
分析 A、常温时,Na2CO3溶解度较大;
B、氧化性为Fe3+>Cu2+,金属活动顺序表中,排在后边的金属阳离子氧化性强;
C、元素的最高价含氧酸酸酸性和元素的非金属性有关系;
D、原子晶体的沸点高于分子晶体.
解答 解:A、常温时,Na2CO3溶解度较大,所以溶解度顺序:CaCO3<NaHCO3<Na2CO3,故A错误;
B、氧化性为Fe3+>Cu2+,金属活动顺序表中,排在后边的金属阳离子氧化性强,即氧化性:Mg2+<H+<Cu2+<Fe3+,故B正确;
C、元素的最高价含氧酸酸酸性和元素的非金属性有关系,酸性:H4SiO4<H3PO4<H2SO4<HClO4,故C错误;
D、原子晶体的沸点高于分子晶体,HF分子之间存在氢键,所以沸点高于I2,故D错误.
故选B.
点评 本题考查较为综合,涉及氢键、氧化性比较、溶解度比较等问题,综合考查学生的分析能力和基础知识的综合应用,注意把握相关基础知识,难度中等.

练习册系列答案
相关题目
12.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 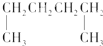 1.4-二甲基丁烷 1.4-二甲基丁烷 | B. | 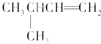 3-甲基丁烷 3-甲基丁烷 | ||
| C. | 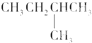 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
19.下列化合物不能由单质直接化合生成的是( )
| A. | Cu2S | B. | Al2S3 | C. | Fe2S3 | D. | FeS |
13.某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )
①通过化学变化可以实现16O与18O间的相互转化
②石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物.
①通过化学变化可以实现16O与18O间的相互转化
②石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物.
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
14.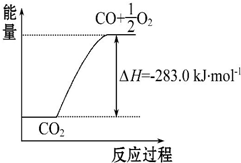 已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.
下列说法正确的是( )
 已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.
下列说法正确的是( )
| A. | 通常状况下,氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 由①可知,1 mol CO(g)和$\frac{1}{2}$mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量 | |
| C. | 可用右图表示2CO2(g)═2CO(g)+O2(g)反应过程中的能量变化关系 | |
| D. | 分解1 mol H2O(g),其反应热为-241.8 KJ |

 .
. .
. .
.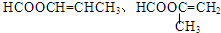 .
.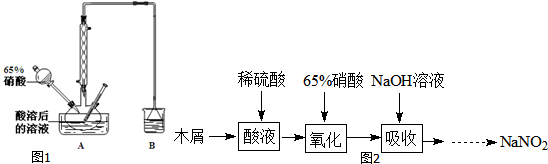
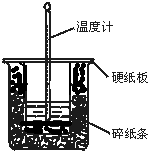 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: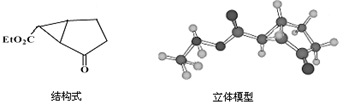
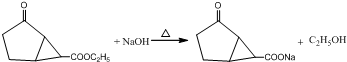 .
.