题目内容
16.如图是某药物中间体的结构示意图: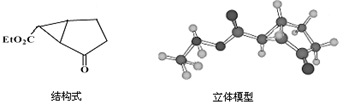
试回答下列问题:
(1)观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示乙基;该药物中间体分子的化学式为C9H12O3.
(2)该化合物属于cd(填编号)
a.羧酸b.醛 c.环酮 d.酯
(3)该化合物能发生的反应有b
a.酯化b.加成c.银镜反应d.消除
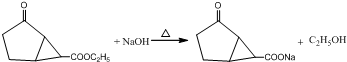
(4)写出该化合物与NaOH水溶液反应的化学方程式
 .
.
分析 (1)由结构式与立体模型对比,可知结构式中的“Et”表示乙基,由结构式可知分子式;
(2)根据官能团判断;
(3)含有羰基,可发生加成反应,含有酯基,可发生水解反应;
(4)含有酯基,可发生水解反应.
解答 解:(1)由结构式与立体模型对比,可知结构式中的“Et”含2个C原子和5个H原子,表示乙基,由结构式可知分子式为C9H12O3,
故答案为:乙基;C9H12O3;
(2)由结构可知有机物含有羰基,属于酮,且为环酮,含有酯基属于酯类,故答案为:cd;
(3)含有羰基,可发生加成反应,含有酯基,可发生水解反应,不能发生酯化、银镜反应、消去反应,故答案为:b;
(4)含有酯基,可发生水解反应,在氢氧化钠溶液中反应的方程式为,故答案为:
点评 本题考查有机物的结构与性质,为高频考点,把握结构式与立体模型、核磁共振氢谱图为解答的关键,侧重结构分析的考查,题目难度不大.

练习册系列答案
相关题目
15.在密闭容器中进行反应:A(g)+2B(g)?3C(g)+D(s),有关下列图象的说法不正确的是( )
| A. | 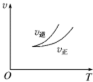 依据图可判断正反应为放热反应 | |
| B. |  在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 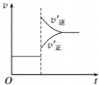 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 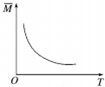 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
7.下列各有机化合物的命名正确的是( )
| A. | CH2═CH-CH═CH2 1,3二丁烯 | B. |  3丁醇 3丁醇 | ||
| C. |  甲基苯酚 甲基苯酚 | D. |  2甲基丁烷 2甲基丁烷 |
4.下列各组物质性质比较中正确的是( )
| A. | 常温常压下溶解度:CaCO3<Na2CO3<NaHCO3 | |
| B. | 氧化性:Mg2+<H+<Cu2+<Fe3+ | |
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO | |
| D. | 沸点:SiC>I2>Si>HF |
11.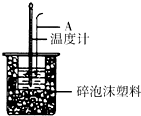 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.7kJ/mol
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac
a.实验装置保温、隔热效果差
b.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.7kJ/mol
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
a.实验装置保温、隔热效果差
b.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
1.将收集满纯净氯化氢气体的试管倒立在盛有紫色石蕊试液的水槽中,可以看到( )
| A. | 试管中液面略有上升 | B. | 液面升至试管的$\frac{1}{2}$处 | ||
| C. | 红色液体几乎充满试管 | D. | 无明显现象 |
8.下列叙述中正确的是( )
| A. | 常温常压下,18 g H2O含有的原子数为NA | |
| B. | 1.8 g的NH4+离子中含有的电子数为0.1 NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.2NA |
5.下列物质中只有离子键的是( )
| A. | NaOH | B. | CaBr2 | C. | H2 | D. | H2S |
6.下列物质既能发生消去反应,又能氧化成醛的是( )
| A. | 1-丙醇 | B. | 2,2-二甲基-1-丙醇 | ||
| C. | 2,2,2-三溴乙醇 | D. | 苯甲醇 |